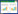2. 福建医科大学附属第一医院滨海院区国家区域医疗中心重症医学科,福州 350200;
3. 宁德市古田县总医院重症医学科,宁德 352200;
4. 福建医科大学病理学系,福州 350005
2. Department of Intensive Care Unit, National Regional Medical Center, Binhai Branch, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350212, China;
3. Department of Intensive Care Unit, Gutian County General Hospital, Ningde 352200, China;
4. Department of Pathology, Fujian Medical University, Fuzhou 350005, China
脓毒症是机体对感染反应失调引起的临床综合征,每年威胁着全球数百万患者的生命安全,其中1/6~1/3的患者常因脓毒症及其并发症而死亡[1]。肺是脓毒症时最易受损伤的靶器官,脓毒症相关急性肺损伤(acute lung injury, ALI)发生率高,病死率也高[2],因其发病机制复杂,目前仍未阐明,临床上亦没有明确的治疗靶点,部分患者的预后也不尽如人意,仍是临床的一大难题[3]。
近年来,胰岛素生长因子(insulin-like growth factor, IGF)家族与炎症之间的研究逐渐增多。IGF家族在细胞的增殖、分化、凋亡等过程中起着重要作用[4],尤其是IGF-1,该分子对细胞分化和增殖、以及机体的免疫反应等生物学功能具有调节作用,并在流感病毒感染、创伤应激反应、胰岛素抵抗等多种疾病的病理生理过程均有所参与[5]。已有学者发现脓毒症患者的血清中IGF-1显著降低,并且IGF-1的降低可能会增加脓毒症时细菌移位,加重病情的进展,并猜测IGF-1或可缓解病情[6],但进一步的相关研究甚少,IGF-1能否缓解脓毒症诱导的ALI及其介导的通路机制尚不明确。
本研究通过盲肠结扎穿刺法(cecal ligation and puncture, CLP)构建脓毒症相关急性肺损伤(sepsis associated acute lung injury, SA-ALI)小鼠模型,阐明IGF-1对SA-ALI的作用及可能介导的信号通路,为治疗SA-ALI寻找新的潜在靶点。
1 材料与方法 1.1 实验对象20只SPF级6~8周龄雄性C57BL/6J小鼠均购自福建医科大学实验动物中心。放入普通环境中,进行为期5 d的检疫观察,无异常后即可进行使用,继续后续实验。小鼠饲养在普通环境IVC中,饲养环境要求:温度20~26 ℃,湿度40%~70%。饲料使用大小鼠维持饲料,饲料与饮用水保证定期更换,保证食饮自由。本研究中动物实验的操作遵照福建医科大学的动物伦理要求并已获得审批(伦理编号:FJMU IACUC 2021-0433)。
1.2 试剂与仪器本实验使用试剂与仪器包括IGF-1(批号:0332888PC063,近岸蛋白公司,中国);PI3K抗体(T40115)、p-PI3K抗体(T40116)、AKT抗体(T55561)和p-AKT抗体(T40067)均购于上海Abmart科技有限公司(中国);小鼠白细胞介素(interleukin, IL)-6 ELISA科研试剂盒(88-7064)和小鼠IL-1β ELISA科研试剂盒(88-7013)购于Thermo公司(美国);低温高速离心机(贝克曼公司,美国);酶标仪(Thermo公司,美国)。
1.3 脓毒症小鼠模型制备及分组 1.3.1 动物造模C57BL/6J小鼠异氟烷吸入麻醉,固定在操作台,剃毛后用75%酒精消毒腹部皮肤。按照CLP法[7]制作SA-ALI模型。术后立即皮下注射生理盐水补液;12 h昼夜节律,给予自由进食饮水。
模型成功的标准为:小鼠术后24 h内出现体重的明显下降,表现出活动减少、嗜睡、反应迟钝等症状,24 h病死率在30%~70%之间(本研究为39%)等即可认为造模成功。
1.3.2 动物分组及处理20只SPF级6~8周龄雄性C57BL/6J小鼠,随机分为4组(随机数字法),具体分组为如下:(1)假手术组;(2)脓毒症组;(3)脓毒症+IGF-1组;(4)假手术+IGF-1组。假手术组不需结扎和穿刺盲肠,其余步骤同脓毒症组。其中假手术+IGF-1组及脓毒症+IGF-1组经尾静脉注射IGF-1,干预浓度为60 μg/(kg·d)[8-10],连续注射3 d,假手术组和脓毒症组小鼠同样经尾静脉给3 d等体积生理盐水干预。
1.4 肺组织湿/干比重测定切取右肺上叶组织后,使用生理盐水进行漂洗,然后吸干表面水分,此时所称得的质量即为肺的湿质量(W),下一步用烘箱将其烘干至完全脱水且干燥,再次称得的质量即为肺的干质量(D),计算并得出此样本的湿/干质量比率(W/D)。
1.5 肺组织病理形态分析及病理学评估切取小鼠左肺上叶组织,使用4%甲醛固定48 h,梯度酒精逐步脱水,二甲苯透明,石蜡包埋,制作相应的组织蜡块,切片后行HE染色,并使用Smith评分标准[11]评估肺损伤程度。
1.6 ELISA检测血液中IL-6和IL-1β含量收集小鼠的腹主动脉血,4 ℃、3 000 r/min离心17 min,吸取上层血清冻于-80 ℃冰箱,后续行ELISA测定其中IL-6和IL-1β表达量。
1.7 ELISA检测肺泡灌洗液中IL-6和IL-1β含量将小鼠右肺门结扎,用4 ℃生理盐水经气管插管缓慢注入左肺进行支气管肺泡灌洗,每次灌洗量0.5 mL,共灌洗3次,4 ℃、3 000 r/min离心17 min,收集上清液存于-80 ℃冰箱,后续使用ELISA试剂盒分析其中IL-6和IL-1β的表达量。
1.8 Western blot检测肺组织中PI3K、p-PI3K、AKT和p-AKT的表达取小鼠左肺下叶组织,添加一定量蛋白裂解液(RIPA∶PMSF =100∶1),使用组织研磨仪研磨30 min,4 ℃、12 000 r/min离心17 min后小心吸取上清液,蛋白液按比例加入5x SDS-PAGE缓冲液,加热10 min使蛋白变性。往8%或者10%的蛋白电泳凝胶中加入适量蛋白样本进行电泳,结束后进行转膜,将带有蛋白的PVDF膜用封闭液封闭1.5 h,加入一抗4 ℃孵育过夜,第2天进行二抗孵育及曝光成像后分析。
1.9 统计学方法采用SPSS 19.0软件进行统计学分析,数据以均值±标准差(x±s)表示,数据为正态分布且方差齐时,采用两独立样本t检验进行两组间比较;数据不符合正态分布或方差不齐时,则采用非参数秩和检验(Mann-Whitney U检验或Kruskal-Wallis H检验)。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠肺组织形态及W/D假手术组的肺脏颜色淡粉,包膜完整,弹性良好,没有出现充血、肿胀或淤斑等现象。而脓毒症组的肺脏外形稍微收缩,表面充血,颜色暗红,包膜下大片淤斑及片状出血。脓毒症+IGF-1组肺脏表面的充血减少,包膜下淤斑及出血灶较脓毒症组均有所减少,见图 1A。假手术+IGF-1组肺脏体积与假手术组相差不大。
|
| 注:A为各组小鼠肺组织形态;B为各组小鼠肺组织W/D;脓毒症组W/D与假手术组比较,a P < 0.05;脓毒症+IGF-1组W/D与脓毒症组比较,b P < 0.05 图 1 各组小鼠肺组织形态及W/D Fig 1 Lung tissue morphology and dry-to-wet ratio of mice in each group |
|
|
与假手术组相比,脓毒症组肺W/D明显升高[(5.46±0.56) vs. (5.14±0.17),t=2.707,P < 0.05],脓毒症+IGF-1组W/D较脓毒症组有所下降[(4.67±0.18) vs. (5.46±0.56),t=-11.362,P < 0.05],见图 1B。
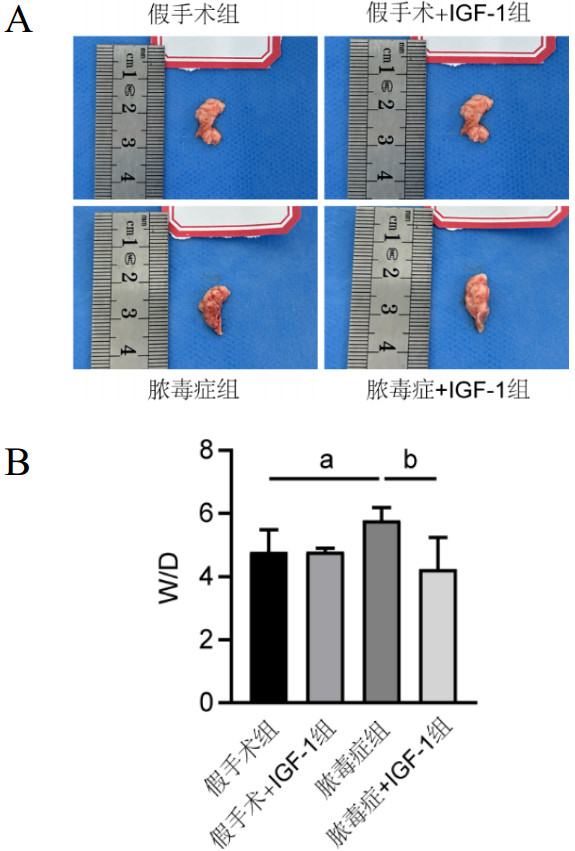
2.2 各组小鼠HE染色及肺损伤病理评分HE染色结果显示,假手术组肺组织的结构大致正常,脓毒症组肺组织明显受损,肺泡间隔增厚,肺泡内可见明显水肿、充血,炎性细胞广泛浸润,肺损伤评分明显升高[(10.00±1.00) vs. (2.33±0.58),t=11.500,P < 0.001]。脓毒症+IGF-1组小鼠肺组织炎症好转,充血水肿和浸润的炎性细胞有所减少,病理损伤评分下降,提示肺部炎症有所改善[(3.00±1.00) vs. (10.00±1.00),t=-8.573,P < 0.01],见图 2。
|
| 注:A为各组小鼠肺组织HE染色(×200, bar=60 μm);B为各组小鼠肺损伤病理评分;脓毒症组肺损伤评分与假手术组比较,a P < 0.001;脓毒症+IGF-1组肺损伤评分与脓毒症组比较,b P < 0.01 图 2 各组小鼠肺组织HE染色及肺损伤病理评分 Fig 2 HE staining and pathological score of lung injury in mice of each group |
|
|
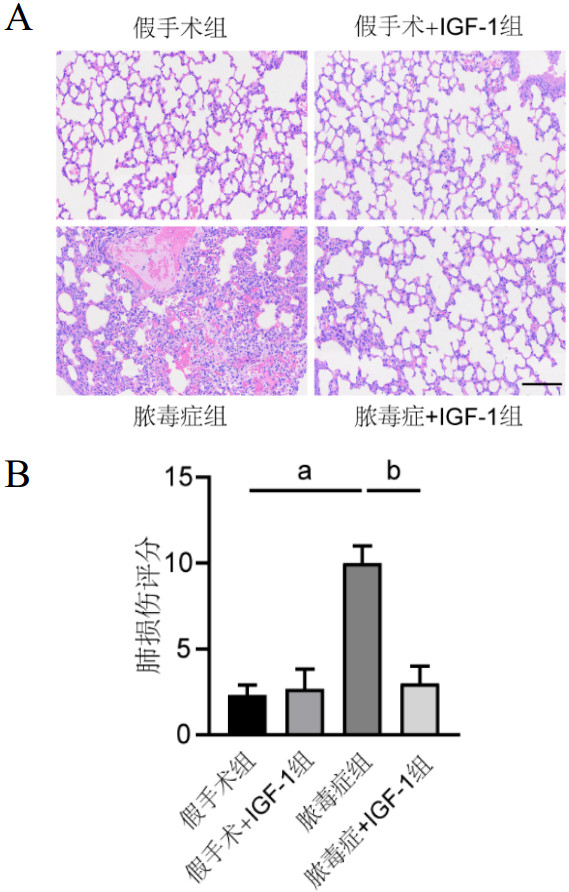
脓毒症组小鼠血清中的IL-6和IL-1β含量比假手术组增加[(45.61±7.85) pg/mL vs. (5.91±0.60) pg/mL,t=8.732,P < 0.001;(181.26±10.11) pg/mL vs. (84.16±4.62) pg/mL,t=15.131,P < 0.001],而脓毒症+IGF-1组血清中IL-6和IL-1β含量则比脓毒症组有所减少[(26.22±1.60) pg/mL vs. (45.61±7.85) pg/mL,t=-4.193,P < 0.05;(87.99±11.80) pg/mL vs. (181.26±10.11) pg/mL,t=-10.396,P < 0.001],见图 3。
|
| 注:A为各组小鼠血清中IL-6含量;B为各组小鼠血清中IL-1β含量;脓毒症组IL-6含量与假手术组比较,a P < 0.001;脓毒症+IGF-1组IL-6含量与脓毒症组比较,b P <0.05;脓毒症组IL-1β含量与假手术组比较,c P < 0.001;脓毒症+IGF-1组IL-1β含量与脓毒症组比较,d P < 0.001 图 3 各组小鼠血清中IL-6及IL-1β含量 Fig 3 The contents of IL-6 and IL-1β in serum in mice in each group |
|
|
脓毒症组小鼠的BALF中IL-6和IL-1β的含量比假手术组明显增加[(20.25±0.43) pg/mL vs. (8.60±0.10) pg/mL,t=45.678,P < 0.001;(108.61±5.18) pg/mL vs. (19.73±5.51) pg/mL,t=20.361,P < 0.001],而脓毒症+IGF-1组的BALF中IL-6和IL-1β含量则比脓毒症组明显减少[(7.67±0.42) pg/mL vs. (< 0.25±0.43) pg/mL,t=-36.208,P < 0.001;(17.0±6.08) pg/mL vs. (108.61±5.18) pg/mL,t=-19.778,P < 0.001],见图 4。
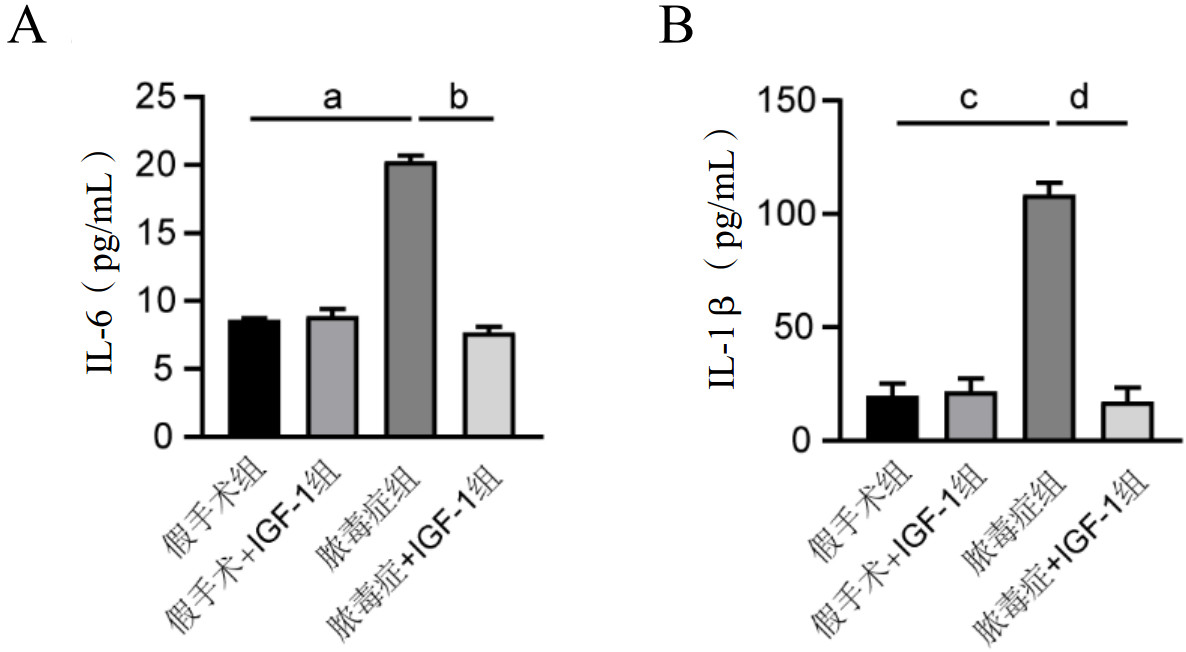
|
| 注:A为各组小鼠BALF中IL-6含量;B为各组小鼠BALF中IL-1β含量;脓毒症组IL-6含量与假手术组比较,a P < 0.001;脓毒症+IGF-1组IL-6含量与脓毒症组比较,b P < 0.001;脓毒症组IL-1β含量与假手术组比较,c P < 0.001;脓毒症+IGF-1组IL-1β含量与脓毒症组比较,d P < 0.001 图 4 各组小鼠BALF中IL-6及IL-1β含量 Fig 4 The contents of IL-6 and IL-1β in BALF in mice in each group |
|
|
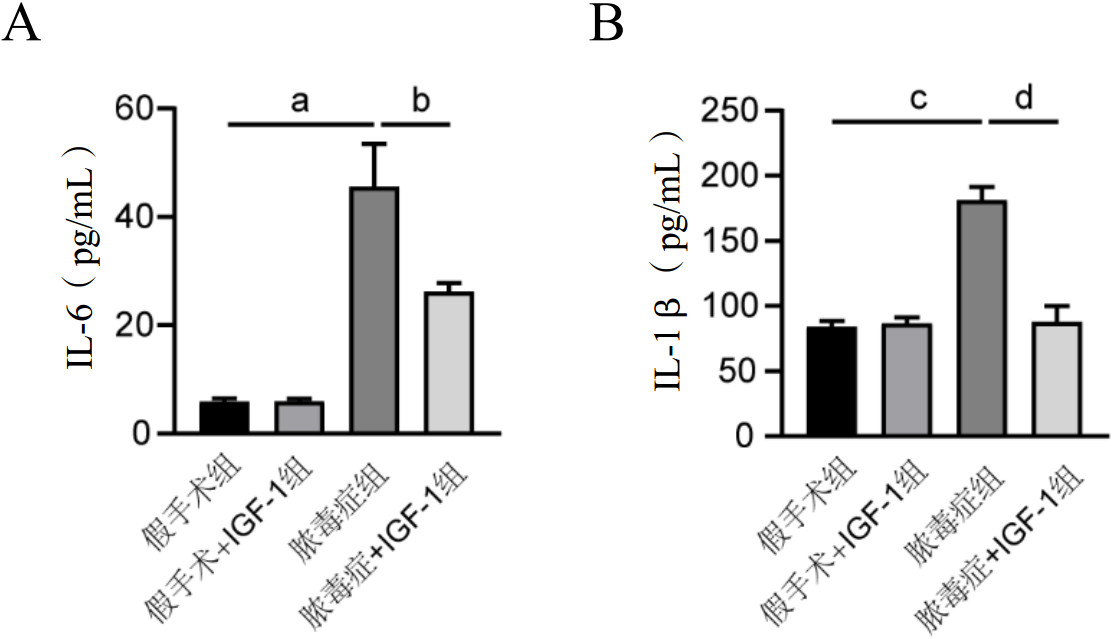
Western blot发现,与假手术组相比,脓毒症组的肺组织中p-PI3K、PI3K蛋白显著上调[(1.21±0.09) vs. (0.44±0.04),t=13.427,P < 0.001;(1.24±0.22) vs. (0.67±0.05),t=4.315,P < 0.05],p-AKT和AKT的表达也上调[(1.10±0.04) vs. (0.35±0.09),t=4.838,P < 0.001;(1.19±0.07) vs. (0.58±0.20),t=13.328,P < 0.01]。而在IGF-1处理后,肺组织中p-PI3K、PI3K、p-AKT和AKT则比脓毒症组明显减少[(0.71±0.05) vs. (1.21±0.09),t=-8.465,P < 0.05;(0.57±0.08) vs. (1.24±0.22),t=-4.861,P < 0.01;(0.29±0.07) vs. (1.10±0.04),t=-5.056,P < 0.001;(0.65±0.17) vs. (1.19±0.07),t=-16.543,P < 0.01],见图 5。
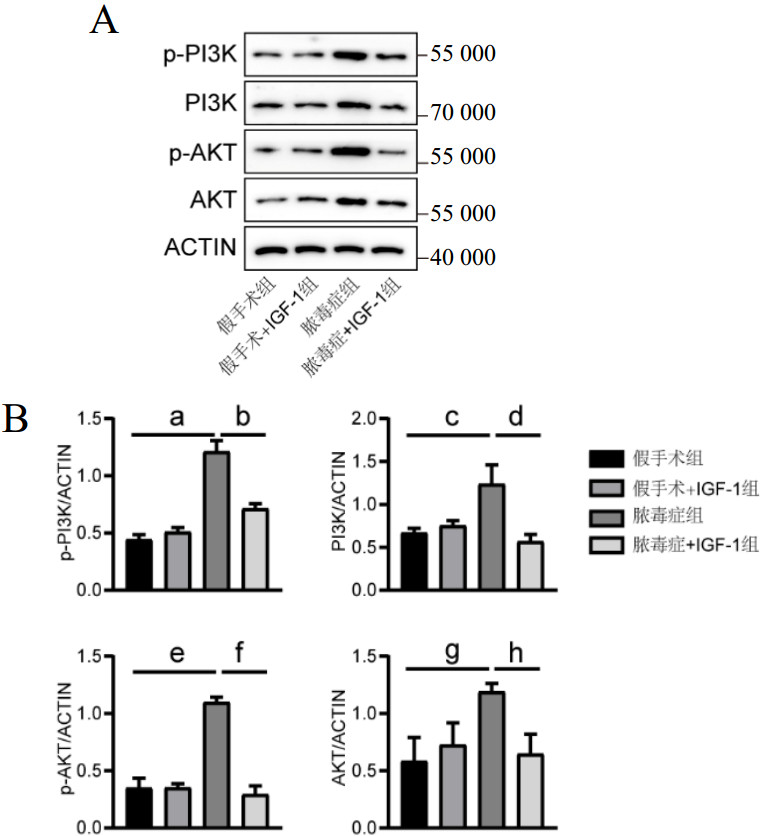
|
| A:各组小鼠肺组织中PI3K、p-PI3K、AKT和p-AKT蛋白表达;B:各组小鼠肺组织中PI3K、p-PI3K、AKT和p-AKT蛋白表达量化;脓毒症组p-PI3K表达与假手术组比较,a P < 0.001;脓毒症+IGF-1组p-PI3K表达与脓毒症组比较,b P < 0.05;脓毒症组PI3K表达与假手术组比较,c P < 0.05;脓毒症+IGF-1组PI3K表达与脓毒症组比较,d P < 0.01;脓毒症组p-AKT表达与假手术组比较,e P < 0.001;脓毒症+IGF-1组p-AKT表达与脓毒症组比较,f P < 0.001;脓毒症组AKT表达与假手术组比较,g P < 0.01;脓毒症+IGF-1组AKT表达与脓毒症组比较,h P < 0.01 图 5 各组小鼠肺组织中PI3K、p-PI3K、AKT和p-AKT蛋白表达 Fig 5 The protein expressions of PI3K, p-PI3K, AKT and p-AKT in the lung tissues of mice in each group |
|
|
脓毒症作为临床常见的危重症疾病,发病率和死亡率极高,是全球健康面临的重大挑战[1]。脓毒症是由感染所引起的机体持续性、失控性炎性反应,并继发器官功能障碍,肺脏是最易损的器官[2]。ALI的发病机制复杂,与免疫细胞浸润、促炎介质的释放均有密切关系[12]。SA-ALI发病率高、急性起病、病情严重、预后差,是临床上一个棘手的问题,因此,阐明脓毒症相关急性肺损伤的发病机制,尽快找到行之有效的治疗方法具有重要的临床和社会价值。
IGF-1是一种肝脏合成分泌的肽类激素,通过内分泌、自分泌、旁分泌的形式调控靶细胞分化和增殖的功能,同时也能抑制细胞凋亡。Warzecha等[13]研究发现,IGF-1可以通过减少胰腺组织炎性细胞浸润和降低白细胞介素的产生而减轻胰腺的损害。国内学者研究发现IGF-1能够通过抑制重症胰腺炎小鼠的肺泡细胞凋亡来减少肺部的炎症损伤,表现出类似的抗炎作用[10]。Hunninghake等[6]发现脓毒症患者血清中IGF-1显著降低,并且IGF-1的降低可能会增加脓毒症时细菌移位,加重病情的进展。游婷婷和石松菁[14]对比研究了48例脓毒症患者,发现脓毒症患者IGF-1水平明显低于对照组,提示前者明显存在CH-IGF-1轴功能异常,并认为脓毒症患者往往伴有神经-内分泌-免疫功能异常,除了引起激素水平异常外,还有免疫功能异常,因此提高IGF-1功能可能改善患者免疫功能,改善其预后,降低病死率。而本实验研究即发现脓毒症组小鼠肺组织W/D比较假手术组明显升高,肺损伤病理评分明显升高,但经过IGF-1处理后肺组织W/D值有所减低,肺损伤明显缓解,提示IGF-1对于SA-ALI有一定的治疗作用。
IL家族是炎症反应过程中的关键分子,其中IL-6、IL-1β是代表因子之一,常常被用来判断炎症反应的程度[15]。特别是血清IL-6水平在感染、创伤等炎症刺激后数分钟内就可出现升高,且与机体炎症反应的剧烈程度、脏器功能障碍及脓毒症相关性死亡密切相关[16]。当感染或损伤发生后,大量炎症介质释放,中性粒细胞穿过毛细血管屏障迁移到肺间质和肺泡内,大量液体渗出和细胞碎片蓄积于肺泡腔,血管内皮细胞受损,血管渗漏及微血栓形成,造成呼吸功能衰竭,其中IL-6发挥至关重要的作用[17]。而IL-1β在正常机体内,先是作为无活性前体的存在,经caspase-l剪切后释放,从而发挥促炎作用。有学者亦证实脓毒症小鼠肺组织中炎症因子IL-1β水平有显著上升,并参与细胞焦亡的过程[18]。本研究中,脓毒症组小鼠血清的IL-6、IL-1β明显高于假手术组(P < 0.001),在经过IGF-1进行干预后IL-6、IL-1β较脓毒症组有所降低(P < 0.001)。后续实验发现,经过IGF-1处理的脓毒症小鼠(脓毒症+IGF-1组)的BALF中的IL-6、IL-1β也较脓毒症组明显降低(P < 0.001),进一步从分子层面上印证了IGF-1对于SA-ALI的抗炎作用。
本研究结果显示,脓毒症组小鼠组织中PI3K/AKT信号被激活,p-PI3K和p-AKT的表达明显比假手术组升高(P < 0.001),再经IGF-1治疗之后,p-PI3K和p-AKT的表达显著下调(P < 0.05),提示IGF-1可能是通过阻断PI3K/AKT通路从而缓解脓毒症小鼠的急性肺损伤。PI3K/AKT通路是炎症和氧化应激过程中最常见的信号转导通路之一[19]。PI3K的激活是炎症反应过程中的关键步骤[20]。前已述及,SA-ALI发病的一个重要病理变化是肺毛细血管内皮细胞的通透性增加,而PI3K的抑制药物则可以起到缓解作用[21]。有学者研究指出当机体因脓毒症发生急性肺损伤时,中性粒细胞趋化聚集在肺部,启动炎症反应以应对病原体入侵,但这种炎症反应同时也会导致肺泡内皮细胞受损,微血管屏障受损,血管通透性增加,PI3K/AKT通路在其中即扮演重要角色[22]。Li等[23]发现中性粒细胞弹性蛋白酶抑制剂西维来司他钠可以通过抑制PI3K/AKT信号通路从而减轻脓毒症的炎症损伤,证明了PI3K/AKT通路在脓毒症中的重要性。SA-ALI另一个重要的病理变化是肺泡内纤维化和弥漫性肺泡损伤。有学者在COVID-19重症患者的肺组织中发现PI3K/AKT/mTOR通路活化和成纤维细胞的异常生长[24]。另有研究表明,通过抑制PI3Ks,特别是PI3Kγ和PI3Kα,可以调节转化生长因子-β刺激的下游信号传导,最终减少脓毒症相关肺损伤引发的肺泡内纤维化[25]。另有学者指出,PI3K/AKT通路的抑制后,会减少炎症因子的释放,从而缓解ALI的损伤,提示PI3K/AKT通路是ALI发生发展的重点,也是治疗的重点[26],也佐证了IGF-1缓解SA-ALI的可行性。
本研究证实IGF-1对脓毒症诱导小鼠急性肺损伤有一定的抗炎效应,其机制可能是通过抑制PI3K/AKT通路而实现,其在脓毒症的诊治中将是一个潜在价值的治疗靶点,并有待进一步的临床研究证实。
志谢: 福建医科大学公共卫生学院胡志坚教授给予统计学方法的指导和审核
利益冲突 所有作者声明无利益冲突
作者贡献声明 黄鹏:论文撰写;郑丽丽、李士康:研究设计、论文修改;王美凤、江金华、李莹:实验操作、数据收集及整理;刘春鹤、林建东、林晓:提供研究经费、文章指导
| [1] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [2] | Vincent JL, Jones G, David S, et al. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis[J]. Crit Care, 2019, 23(1): 196. DOI:10.1186/s13054-019-2478-6 |
| [3] | 郭君平, 潘然, 王丽君, 等. 利拉鲁肽对脓毒症小鼠急性肺损伤的保护作用及其机制[J]. 中华急诊医学杂志, 2024, 33(8): 1134-1139. DOI:10.3760/cma.j.issn.1671-0282.2024.08.010 |
| [4] | Moonesi M, Zaka Khosravi S, Molaei Ramshe S, et al. IGF family effects on development, stability, and treatment of hematological malignancies[J]. J Cell Physiol, 2021, 236(6): 4097-4105. DOI:10.1002/jcp.30156 |
| [5] | Józefiak A, Larska M, Pomorska-Mól M, et al. The IGF-1 signaling pathway in viral infections[J]. Viruses, 2021, 13(8): 1488. DOI:10.3390/v13081488 |
| [6] | Hunninghake GW, Doerschug KC, Nymon AB, et al. Insulin-like growth factor-1 levels contribute to the development of bacterial translocation in sepsis[J]. Am J Respir Crit Care Med, 2010, 182(4): 517-525. DOI:10.1164/rccm.200911-1757OC |
| [7] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [8] | 曹蘅, 蔚有权, 杨浩. 重组人胰岛素样生长因子-1对大鼠缺血性坏死心肌的保护作用[J]. 中华急诊医学杂志, 2008, 17(2): 173-176. DOI:10.3760/j.issn:1671-0282.2008.02.014 |
| [9] | 王映珍, 王世文, 高宁, 等. 胰岛素样生长因子-Ⅰ对重症急性胰腺炎大鼠小肠黏膜上皮细胞凋亡的影响[J]. 中华急诊医学杂志, 2009, 18(6): 618-622. DOI:10.3760/cma.j.issn.1671-0282.2009.06.017 |
| [10] | 孙志江, 王世文, 郑宁, 等. 胰岛素样生长因子1对重症急性胰腺炎大鼠肺损伤细胞凋亡的影响[J]. 第四军医大学学报, 2008(8): 688-691. DOI:10.3321/j.issn:1000-2790.2008.08.006 |
| [11] | Smith KM, Mrozek JD, Simonton SC, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange and lung pathology in an animal model of respiratory distress syndrome[J]. Crit Care Med, 1997, 25(11): 1888-1897. DOI:10.1097/00003246-199711000-00030 |
| [12] | 谷玉雷, 肖莉丽, 裴辉, 等. 西维来司他钠在重症监护室急性肺损伤患者中应用的有效性和安全性研究[J]. 中华急诊医学杂志, 2022, 31(8): 1061-1065. DOI:10.3760/cma.j.issn.1671-0282.2022.08.008 |
| [13] | Warzecha Z, Dembinski A, Ceranowicz P, et al. IGF-1 stimulates production of interleukin-10 and inhibits development of caerulein-induced pancreatitis[J]. J Physiol Pharmacol, 2003, 54(4): 575-590. |
| [14] | 游婷婷, 石松菁. 脓毒症患者生长激素、胰岛素样生长因子-1与免疫的关系[J]. 中华急诊医学杂志, 2017, 26(12): 1442-1446. DOI:10.3760/cma.j.issn.1671-0282.2017.12.022 |
| [15] | Crapnell RD, Jesadabundit W, García-Miranda Ferrari A, et al. Toward the rapid diagnosis of sepsis: detecting interleukin-6 in blood plasma using functionalized screen-printed electrodes with a thermal detection methodology[J]. Anal Chem, 2021, 93(14): 5931-5938. DOI:10.1021/acs.analchem.1c00417 |
| [16] | Cong S, Ma TG, Di X, et al. Diagnostic value of neutrophil CD64, procalcitonin, and interleukin-6 in sepsis: a meta-analysis[J]. BMC Infect Dis, 2021, 21(1): 384. DOI:10.1186/s12879-021-06064-0 |
| [17] | Godo S, Shimokawa H. Endothelial Functions[J]. Arterioscler Thromb Vasc Biol, 2017, 37(9): e108-e114. DOI:10.1161/ATVBAHA.117.309813 |
| [18] | 李增攀, 方建江, 周挺, 等. Caspase-1介导的细胞焦亡在脓毒症小鼠急性肺损伤的作用[J]. 中华急诊医学杂志, 2022, 31(4): 531-533. DOI:10.3760/cma.j.issn.1671-0282.2022.04.018 |
| [19] | Sun XJ, Chen L, He ZY. PI3K/Akt-Nrf2 and anti-inflammation effect of macrolides in chronic obstructive pulmonary disease[J]. Curr Drug Metab, 2019, 20(4): 301-304. DOI:10.2174/1389200220666190227224748 |
| [20] | Deng CY, Lv M, Luo BH, et al. The role of the PI3K/AKT/mTOR signalling pathway in male reproduction[J]. Curr Mol Med, 2021, 21(7): 539-548. DOI:10.2174/1566524020666201203164910 |
| [21] | Ourradi K, Blythe T, Jarrett C, et al. VEGF isoforms have differential effects on permeability of human pulmonary microvascular endothelial cells[J]. Respir Res, 2017, 18(1): 116. DOI:10.1186/s12931-017-0602-1 |
| [22] | He YQ, Zhou CC, Yu LY, et al. Natural product derived phytochemicals in managing acute lung injury by multiple mechanisms[J]. Pharmacol Res, 2021, 163: 105224. DOI:10.1016/j.phrs.2020.105224 |
| [23] | Li GF, Jia J, Ji KQ, et al. The neutrophil elastase inhibitor, sivelestat, attenuates sepsis-related kidney injury in rats[J]. Int J Mol Med, 2016, 38(3): 767-775. DOI:10.3892/ijmm.2016.2665 |
| [24] | Kindrachuk J, Ork B, Hart BJ, et al. Antiviral potential of ERK/MAPK and PI3K/AKT/mTOR signaling modulation for Middle East respiratory syndrome coronavirus infection as identified by temporal kinome analysis[J]. Antimicrob Agents Chemother, 2015, 59(2): 1088-1099. DOI:10.1128/AAC.03659-14 |
| [25] | Campa CC, Silva RL, Margaria JP, et al. Inhalation of the prodrug PI3K inhibitor CL27c improves lung function in asthma and fibrosis[J]. Nat Commun, 2018, 9(1): 5232. DOI:10.1038/s41467-018-07698-6 |
| [26] | 张朋云, 陈淼. PI3K/AKT信号传导通路在急性肺损伤发生发展中作用的研究进展[J]. 山东医药, 2016, 56(45): 99-101. DOI:10.3969/j.issn.1002-266X.2016.45.034 |
 2025, Vol. 34
2025, Vol. 34