急性主动脉综合征(acute aortic syndrome, AAS)是以主动脉壁完整性受损为特征的心血管急症,可累及主动脉任意节段,一旦发病病死率极高。目前急诊外科治疗是AAS的首选治疗方案,但是无论即将接受手术还是因为各种原因无法接受手术治疗的患者,均有必要接受非外科治疗。尽管国际指南有推荐的AAS非外科治疗方案,但细节较少,特别是伴有脏器灌注不良时的治疗方案有限,且不同治疗方案的结局差异较大。此外,尽管国内已有高血压急症诊疗的专家共识,对AAS患者血压的管理提供指导,但是尚未涵盖继发脏器灌注不良的处理意见。因此,由国家心血管疾病临床医学研究中心、首都医科大学附属北京安贞医院牵头,联合中国医师协会心血管外科医师分会、中华医学会急诊医学分会成立专家工作组,以多学科协作综合救治为原则,涉及急诊科、危重症医学科、心脏大血管外科、外周血管科、神经内科、消化内科、肾内科、骨科等学科,参考国内外相关指南、共识、论著等文献,结合中国临床实际,制订了一套针对AAS的标准化、规范化的非外科强化治疗方案,旨在全周期、多维度、精准指导非外科治疗的实施,进而改善AAS患者的预后。
1 急性主动脉综合征(AAS)疾病介绍及现有治疗的局限 1.1 基本介绍急性主动脉综合征(acute aortic syndrome,AAS)是一组严重威胁人类生命健康的心血管疾病,以主动脉壁完整性受到破坏为特点的主动脉急症,可以发生在主动脉的任意节段。主要包括主动脉夹层(aortic dissection, AD)、壁内血肿(intramural hematoma, IMH)、主动脉穿通性溃疡(penetrating aortic ulcer, PAU),这些疾病都可以导致主动脉破裂。根据发病时间可分为急性期(≤14 d),亚急性期(15~90 d),慢性期(>90 d)[1]。
AAS的30 d病死率从11%~90%不等[2-7],其中以急性A型主动脉夹层预后最差。发病后2 d病死率可达50%,发病后30 d病死率高达90%[8-9]。急性B型主动脉夹层发病后30 d病死率在10%~25%。有研究报道A型壁内血肿患者的30 d病死率可达26%。随访3年的病死率可高达40%。B型壁内血肿患者的30 d病死率为 < 10%;主动脉穿通性溃疡自然病死率据研究报道差异有统计学意义。一项随访3.5年的研究报告其病死率在3%~40%之间,这取决于是否存在症状学或高危特征[10-12]。
1.2 AAS的并发症由于主动脉壁完整性受到破坏,AAS可能会导致主动脉瓣功能受损或主动脉分支血管缺血,进而导致脏器灌注不良综合征,并产生相关临床表现:(1)累及主动脉瓣,可出现新发的主动脉瓣听诊区杂音,可出现胸闷、呼吸困难症状;(2)累及到冠状动脉,可出现发作性胸骨后疼痛、紧缩感、压榨或压迫感、烧灼感或心前区不适等症状,表现为急性冠状动脉综合征;(3)累及颈动脉或椎动脉,可出现突发晕厥、意识障碍、言语不清、面部或一侧肢体麻木无力等相关症状;(4)累及锁骨下动脉,可出现双上肢的血压不对称(> 20 mmHg, 1 mmHg=0.133 kPa),或出现上下肢体血压的不对等(> 20 mmHg);(5)累及肋间动脉,可出现颈背部的疼痛或不适感、下肢的感觉运动障碍、步态障碍或痉挛步态、排尿功能障碍等症状;(6)累及腹腔干或肠系膜动脉,可出现腹痛、呕血、便血等相关症状;(7)累及单侧或双侧肾动脉,可出现无尿或少尿症状;(8)累及髂动脉,可出现单侧或双侧下肢的疼痛、足背动脉的减弱或消失等症状,可出现双下肢的血压不对称(> 20 mmHg),或出现上下肢体血压的不对等(> 20 mmHg)。
AAS的发生还可继发主动脉直径的扩张,进而导致相邻组织或器官压迫,并产生相关临床表现:压迫食管出现吞咽困难、压迫气管导致呼吸困难、压迫喉返神经导致声音嘶哑、压迫交感神经导致Honer's综合征、压迫上腔静脉导致上腔静脉综合征、压迫臂丛神经导致上肢感觉障碍;压迫胃肠道导致腹胀、腹痛、消化不良。
AAS最凶险的并发症为主动脉破裂,当主动脉破裂时可出现失血性休克的症状。根据破裂部位的不同,可有相应的特征性临床表现:升主动脉、降主动脉破裂导致心包压塞、心肌缺血、胸腔积血时可导致呼吸困难等症状;腹主动脉破裂导致腹膜后出血、腹腔积血时可导致腰背痛、恶心、呕吐、腹膜刺激征等症状[13-15]。
1.3 AAS现有指南推荐治疗方案的局限尽管已有多部国际指南及专家共识给出了方案,确诊后第一时间行急诊手术治疗仍是首选治疗建议。通过外科手术置换病变血管,可以防止主动脉破裂。但仍有约30%的患者因各种原因无法立即开展手术,如需术前等待、存在严重合并症、高龄、解剖结构复杂或存在心脏手术史[15]等。现有研究及指南、专家共识推荐的治疗意见对于非外科强化治疗方案细节有限,不同的治疗方案导致非外科强化治疗的结局差异较大,且现有的非外科强化治疗手段并不规范,使得这部分非外科强化治疗患者难以从现有的治疗体系中获益。基于此,由国家心血管疾病临床医学研究中心、首都医科大学附属北京安贞医院牵头,联合中国医师协会心血管外科医师分会、中华医学会急诊医学分会成立的专家工作组,以多学科协作综合救治为治疗原则,参考国内外相关指南、共识、论著等文献,结合中国临床实际,制订了一套针对AAS的标准化、规范化的非外科强化治疗方案。旨在全周期、多维度、精准指导非外科治疗的实施,进而改善AAS患者的预后。
2 方法与证据 2.1 适用情况 2.1.1 适用范围参与AAS非外科强化治疗的所有医疗工作者和研究人员。
2.1.2 计划目标人群因任何原因(例如医疗机构不具备能力,患者拒绝外科治疗,等待术前检查等)无法立即实施外科治疗的所有AAS患者。
2.1.3 适用环境具备AAS诊断能力及心电监护设备的各级医疗机构。
2.2 制定流程 2.2.1 成立共识制定委员会多学科专家工作组本共识在国际实践指南注册与透明化平台注册(注册号:PREPARE-2025CN352)。本共识已撰写计划书,可通过通讯作者或国际实践指南注册与透明化平台获取,共识工作按计划书预定要求完成。
2.2.2 制订流程基于改良Delphi法,向全国多家医院征求AAS非外科强化治疗相关的临床问题,通过专家讨论和文献调研,凝练AAS非外科强化治疗关注的常见临床需求及临床问题。成立共识制订委员会多学科专家工作组, 参与制订和审阅的专家共计64名,包括主动脉外科或周围血管外科专家40名、急诊与危重症医学专家22名、基础医学专家2名。工作组按其贡献细分为制订组与审阅组:制订组负责整个专家共识的架构设计、内容撰写以及初稿的形成;审阅组负责对制订组完成的初稿进行全面审查与评估,提出针对性的修改意见与建议。
2.2.3 资料来源中文数据库包括万方数据库、中国知网数据库、中国生物医学文献数据库,检索词为“急性主动脉综合征”、“急性主动脉夹层”、“主动脉溃疡”、“主动脉壁间血肿”、“诊断”、“治疗”、“随访”、“动脉插管”、“低温停循环”、“灌注”、“全主动脉置换”、“部分弓置换”、“孙氏手术或全弓置换加支架象鼻手术”、“支架象鼻手术”、“保守治疗或药物治疗”、“杂交手术”、“腔内治疗”等;英文数据库包括cochrane、PubMed、EMBASE、CINAHL、Web of Science,检索词为“Acute Aortic Syndrome”、“Acute Aortic Dissection”、“Aortic Ulcer”、“Intramural Hematoma of Aorta”、“Diagnosis”、“Treatment”、“Follow-up”、“Arterial Cannulation”、“Hypothermic Circulatory Arrest”、“Perfusion”、“Total Aortic Replacement”、“Partial Arch Replacement”、“Sun's Procedure or Total Arch Replacement with Stent Graft Elephant Trunk Procedure”、“Stent Graft Elephant Trunk Procedure”、“Conservative Treatment or Medical Therapy”、“Hybrid Procedure”、“Endovascular Treatment”等。检索期限为2004年1月1日至2025年1月31日。检索限定:纳入系统评价/Meta分析、随机对照试验(RCT)、队列研究、回顾性研究、病例对照研究及病例报告;排除个案报道、专家述评、专题笔谈、讲座。在经过cochrane量表评价证据的偏倚风险或方法学质量后,针对推荐意见纳入与本共识密切相关文献共计51篇。
2.2.4 证据质量及推荐等级采用GRADE证据分级方法对证据进行分级[16]。通过整理提取纳入系统评价研究的质量评价结果做出证据分级(见表 1)。考虑现有证据的质量分级,参照GRADE系统对推荐级别的分级形成指南推荐意见专家咨询表。通过改良Delphi法,组织多轮专家问卷函询及会议讨论,基于各领域专家意见、临床调研结果、文献循证证据、并结合临床医生的应用经验,考虑干预措施利弊、患者治疗所获得的价值、卫生经济状况、患者偏好及药物资源应用等相关因素,最终给出临床应用推荐意见,做出推荐强度分级(见表 2)。
| 证据分级 | 描述 | 研究类型 |
| A级证据 | 非常确信真实的效应值接近效应估计 | RCT 质量升高二级的观察性研究 |
| B级证据 | 对效应估计值有中等程度的信心;真实值有可能接近估计值,但仍存在二者大不相同的可能性 | 质量降低一级的RCT 质量升高一级的观察性研究 |
| C级证据 | 对效应估计值的确信程度有限;真实值可能与估计值大不相同 | 质量降低二级的RCT 观察性研究 |
| D级证据 | 我们对效应估计值几乎没有信心;真实值很可能与估计值大不相同 | 质量降低三级的RCT 质量降低一级的观察性研究 系列病例观察 个案报道 |
| 本指南推荐用语 | 推荐等级 |
| 强推荐 | 支持使用某种疗法的强推荐 |
| 推荐 | 支持使用某种疗法的弱推荐 |
| 暂不推荐 | 不能确定 |
| 不建议 | 反对使用某种疗法的强推荐 |
| 反对 | 反对使用某种疗法的弱推荐 |
| 注:针对临床应用广泛、疗效确切,但没有研究证据的治疗方案,当专家认为有必要在指南中提及该方案时,可采用“推荐,仅依据专家共识” | |
指南编制流程和方法依据《中国制订/修订临床诊疗指南的指导原则》[17]。指南文本撰写依据《GB/T1.1-2020标准化工作导则第1部分:标准化文件的结构和起草规则》[18]。制订组专家根据收集的临床问题,查阅相关文献,结合临床经验,提出推荐意见,阐述相关证据、级别,经20余次线上和线下讨论完成初稿。审核组专家通过改良Delphi法评价推荐意见,提出修改意见。制订组专家根据审核反馈修订共识,最终成稿。
2.2.6 资助来源国家自然科学基金项目(82241205,82422007,82170487,82270514),北京市自然科学基金(JQ24039,7232005,24G10071),北京市科委重点项目(Z221100007422015),北京市医院管理中心“扬帆”计划诊疗能力提升项目(ZLRL202317)。由首都医科大学附属北京安贞医院负责组织完成。资助用于会议组织、指南宣发等。推荐意见未受资助影响。
3 急性主动脉综合征(AAS)的治疗推荐意见1:确诊为AAS的患者,若具备手术指征、无手术禁忌,且接诊医疗机构具备开展急诊外科治疗的能力,推荐立即实施外科治疗。(强推荐,证据等级B级)
AAS属于致死性心血管急症,外科手术是唯一能实现解剖结构根治的核心手段。通过直视下切除病变主动脉段、重建真腔血流通道、消除内膜破口及假腔血流,从而阻断主动脉进行性扩张的恶性循环。外科手术可显著降低主动脉破裂风险,同时有效预防远期动脉瘤样扩张、脏器灌注不良等并发症。需要特别指出的是,主动脉壁一旦发生结构性损伤即具有不可逆性,任何延迟手术的决定都可能导致病情急剧恶化。对于符合手术适应症的患者,及时实施根治性手术是改善预后、挽救生命的根本策略,这一原则已得到国际主动脉疾病指南的强力推荐[1, 8]。
推荐意见2:确诊为AAS的患者,若外科治疗因任何原因(例如医疗机构不具备能力,患者拒绝外科治疗,等待术前检查等)无法立即实施,推荐立即实施非外科强化治疗,直至可实施外科治疗。(强推荐,证据等级B级)
由于AAS手术难度较高,普及率较低,导致多数患者发病后需快速转诊至具备手术能力的医院治疗,带来沉重的诊治压力。因为AAS短期预后差,许多患者在转运过程中就已死亡。英国牛津的一项尸检报道显示,约34.6%的AAS患者在转运过程中死亡[3, 19-20]。到达转诊医院的患者,也有一部分在术前准备阶段发生死亡。大量的术前死亡,导致国际较多地区整体手术率偏低。据统计,近年来我国A型主动脉夹层手术率仅为61.1%[21],低于国际报道的92.5%[22]。但是国外仍然有很多中心存在手术率不足50%的现象[23]。因此对于众多因任何原因导致无法第一时间行外科手术治疗的患者,应立即启动非外科强化治疗,即在有创监测条件下开展的除外科治疗外的多学科综合治疗。在此期间综合评估患者病情变化,直至可实施外科治疗。
推荐意见3:确诊为AAS的患者,计划接受非外科强化治疗时,推荐治疗立即在监护条件下进行,确保尽快将心率与血压控制至目标值,缓解症状,并接受个体化容量管理;在治疗过程中,推荐对病情严重程度进行动态评估,实时监测AAS致命性并发症有无发生。(强推荐,证据等级B级)
对于AAS患者,有条件的单位应在具备监护条件的病房中进行综合管理并绝对卧床,实时监测心律、心率、血压、呼吸、脉氧饱和度、体温、中心静脉压、出入量等生命体征并及时测量腹围、腿围等指标。在治疗的初始1 h内确保AAS患者心率达到60~70次/min、收缩压达到100~120 mmHg的目标值(需要监测双侧血压,必要时监测上下肢血压)。对于存在灌注不良综合征的患者,需要个体化调整血压,维持组织脏器基本灌注的最低血压水平,避免脏器缺血加重导致不良事件发生。对于血压高于目标值的患者,需联合使用降压药,并重视足量β受体阻滞剂的使用。当β受体阻滞剂治疗效果不理想时,可考虑加用非二氢吡啶类钙拮抗剂控制血压,兼顾控制心率及抑制心肌收缩力。AAS患者约20%~30%出现大动脉搏动减弱或消失,并表现为周期性变化[24]。双侧下肢动脉血压可能不一致,双下肢动脉血压差 > 30 mmHg多提示预后不良。治疗期间及时根据患者的出入量进行个体化的容量管理,早期禁食水的患者,应在开始治疗后补足容量,防止出现容量相关的心律失常事件或灌注不良事件。治疗期间存在下列症状或者体征时常提示预后不良,如低血压;肾功能衰竭;意识改变;血便或黑便;下肢缺血;再发胸痛;无脉;心电图ST段抬等[25],应引起足够的重视。
推荐意见4:确诊为急性非复杂型B型主动脉夹层的患者,若未继发并发症,推荐接受非外科强化治疗。(弱推荐,证据等级B级)
根据国际指南,在无急性并发症的情况下,药物治疗是非复杂型的B型主动脉夹层的首选措施[1]。
推荐意见5:确诊为AAS的患者,计划接受非外科强化治疗时,推荐根据患者血压或心率是否符合目标值,以及疼痛症状是否缓解,选择应用药物治疗或仅观察。若计划应用药物治疗,推荐治疗药物剂型首选静脉注射剂型。若患者不存在禁忌,推荐在急性期内逐渐过渡至口服剂型药物治疗。(强推荐,证据等级B级)
确诊为AAS的患者,计划接受非外科强化治疗时,推荐根据患者血压或心率是否符合目标值,以及疼痛症状是否缓解,选择应用药治疗或仅观察。若需应用药物治疗,推荐治疗药物剂型首选静脉注射剂型。对于血压和心率高于目标值的患者,β-受体阻滞剂为控制心率和血压的首选一线药物,宜选择短效可滴定的静脉注射剂型。对于不能耐受β-受体阻滞剂患者或者存在禁忌症时,可以选用非二氢吡啶类钙拮抗剂(维拉帕米、地尔硫䓬)控制血压和心率。应用β-受体阻滞剂或非二氢吡啶类钙拮抗剂患者收缩压仍 > 120 mm Hg,可以加用硝普钠持续静脉输注,调节剂量以更好地控制血压。硝普钠引起的血管舒张会反射性激活交感系统,存在增强心肌收缩力和主动脉剪切应力的作用,反而可能导致AAS的病情恶化,所以未接受β-受体阻滞剂或非二氢吡啶类钙拮抗剂患者,不建议单独给予硝普钠控制血压。对于血压或心率低于目标值的患者,应首先积极寻找病因并解除。当病因尚未明确或无法解决时,可予以适当的升压、提高心率治疗,维持组织、脏器的灌注。升压可以尝试应用血管加压素,提高心率可以尝试应用异丙肾上腺素。但需充分考虑药物与低血压/低心率可能病因的相互作用,避免AAS进一步恶化。当患者不存在禁忌,推荐在急性期内逐渐过渡至口服剂型。治疗期间,任何时候出现血流动力学不稳定应及时气管插管及机械通气治疗。具体血压、心率调控常用药物与使用方法见表 3。
| 常用药物 | 推荐使用方法 |
| 艾司洛尔 | 负荷量0.25~0.5 mg/kg;维持量0.05~0.3 mg/(kg·min) |
| 尼卡地平 | 起始量5 mg/h(15~30 min增加2.5 mg/h至达标);维持量3 mg/h:30 mg+20 mL GS/NS(5 mL/h) |
| 硝普钠 | 维持量[0.25~10 μg/(kg·min)] |
| 乌拉地尔 | 负荷量10~50 mg:2~10 mL;维持量(6~24 mg/h):250 mg(1~5 mL/h) |
| 口服降压药(依据血压情况) | 酒石酸美托洛尔12.5 mg tid起始逐渐加量,稳定后调整为缓释剂型;依血压情况,合并使用一种或两种α受体阻滞剂,CCB,ACEI/ARB等药物 |
| 血管加压素 | 0.02~0.04 units/min 泵入:24 units→50 mL:2.5 mL/h=0.02 units/min 静脉点滴:24 units→250 mL:12.5 mL/h=0.02 μg/(kg·min) |
| 异丙肾上腺素 | 异丙肾上腺素0.5~2 μg/min 静脉点滴:异丙肾上腺素1 mg+500 mL:20 mL/h开始泵入 |
有效的镇静、镇痛可降低交感神经兴奋导致的血压、心率波动。前期研究显示,冬眠合剂(氯丙嗪50 mg、异丙嗪50 mg和杜冷丁100 mg)肌肉注射可以达到很好的效果(具体见表 4和表 5 [26-27])。同时发现纤维蛋白原水平可能在急慢性主动脉夹层中起到关键作用,并发现补充纤维蛋白原有望降低AAS患者早期病死率[28]。此外,通便药物的使用能够避免因便秘导致的腹压骤增和血压波动,从而降低主动脉壁压力,防止AAS患者病情恶化或主动脉破裂。
| 药物 | 等效剂量(IV/PO) | 起效时间(IV) | 消除半衰期 | 与输注时间相关的半衰期 | 代谢途径 |
| 芬太尼 | IV: 0.1 mg | 1~2 min | 2~4 min | 6 min输注:200 min 12 min输注:300 min |
N-去烷基化(CYP3A4/5底物) |
| 氢吗啡酮 | IV: 1.5 mg P0:7.5 mg |
5~15 min | 2~3 min | 不适用 | 葡糖醛酸化 |
| 吗啡 | IV: 10 mg P0:30 mg |
5~10 min | 3~4 min | 不适用 | 葡糖醛酸化 |
| 美沙酮 | N/A | 1~3 d | 15~60 h | 不适用 | N-去甲基化(CYP3A4/5, 2D6) |
| 瑞芬太尼 | N/A | 1~3 min | 3~10 min | 3-4 ~n | 血浆酯酶水解 |
| 分类 | 药物 | 剂量 | 注意事项 |
| 全身麻醉药 | 丙泊酚 | 负荷剂量:0.25~2.0 mg/kg IV 维持剂量:5~50 μg/(kg·min) IV |
丙泊酚输注综合征;LVEF < 50%慎用;可能引起低血压、心动过缓、高脂血症等 |
| α-2肾上腺素受体激动剂 | 右美托咪定 | 负荷剂量:1 μg/kg > 10 min IV 维持剂量:0.2~1.5μg/(kg·h) IV |
慎用于既往有心脏阻滞或心动过缓的患者 |
| 抗焦虑药 | 咪达唑仑 | 负荷剂量:0.01~0.05 mg/kg IV 维持剂量:0.01-0.1 mg/(kg·h) IV |
易引起谵妄和低血压 |
| 劳拉西泮 | 负荷剂量:0.02~0.04 mg/kg, < 4 mg IV 维持剂量:0.01~0.1 mg/(kg·h) IV |
丙二醇毒性需注意 | |
| 抗精神病药物 | 喹硫平 | 50~200 mg每日两次口服 | QTc延长、低血压、高血压及心动过速的风险 |
| 氟哌啶醇 | 负荷剂量:0.5~2.0 mg静脉或肌肉注射 维持剂量:0.5~2.0 mg/h IV |
易引起谵妄、高血压、心动过速等症状 |
推荐意见6:AAS患者继发脏器灌注不良的推荐:
(1)确诊为AAS的患者,计划接受非外科强化治疗时,若患者发生AAS继发脏器灌注不良可疑征象,推荐立即进行专科查体或简易试验,初步排查是否存在脏器低灌注。若不存在检查禁忌,尽早复查计算机断层扫描血管造影(computed tomography angiography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)确定诊断。(强推荐,证据等级B级)
相对于AAS致命性并发症而言,AAS导致的脏器灌注不良同样会严重影响AAS患者的预后。如,缺血性卒中、急性心肌缺血、肠缺血/坏死、急性肾功能不全、肢端缺血等[29]。对于继发脏器灌注不良的患者,非外科强化治疗期间同样需要严密监测腹部体征和肢端缺血征象,推荐对疑似脏器灌注不良的患者进行专科查体或简易试验初步识别。
对于疑似继发脏器灌注不良的患者应及时行CTA,延误诊断是导致继发脏器灌注不良患者死亡的重要因素,尤其是肠道灌注不良。相关指南指出,若出现肠袢扩张、肠系膜上静脉血栓形成、腹腔内游离液体、门静脉血栓形成、脾静脉血栓形成相关的影像学征象,则提示患者出现肠缺血或坏死[29]。
DSA可以准确显示病变部位、性质、范围和程度,但作为一种有创检查,有一定的并发症发生率。在CTA成像不佳、不能明确诊断时,DSA仍是最为重要的检查手段。通过血管造影明确病变部位及性质后,进行腔内治疗。
(2)确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发脏器灌注不良综合征,推荐立即开展多学科会诊,评估介入治疗或外周血管转流手术指征。当指征明确,且无治疗禁忌时,推荐立即接受介入治疗或外周血管转流手术,尽早恢复脏器血液灌注。(强推荐,证据等级B级)
随着介入技术发展,在评估后,介入指征明确的患者可以先行介入开通灌注不良的脏器。对继发脑灌注异常的AAS患者,基于多项RCT研究结果,神经介入治疗已成为四级诊疗中心治疗急性缺血性卒中的标准方法。通过脑血管介入恢复脑血流灌注可以降低AAS继发卒中的病死率,使其与无卒中的AAS患者的病死率相当[30]。
对继发肠系膜灌注异常的AAS患者,虽然关于最佳开通时间的数据仍然有限,但对于情况稳定的患者,在明确灌注不良发生后的6 h内,可以尝试进行经皮血运重建,以恢复胃肠道血运。
对继发肢体灌注异常的AAS患者,应立即进行急诊血运重建手术,其中腔内治疗是首选方式。对于生命体征平稳的患者,可以考虑进行外周血管转流手术,以恢复肢体血供并稳定全身内环境。研究表明,受灌注不良影响的血管床数量与患者的病死率呈正相关,在进行主动脉修复手术之前,优先进行肢体血运重建,有助于降低继发肢端灌注不良的AAS患者的早期病死率[31]。
推荐意见7:确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发脏器灌注不良综合征,且介入治疗或外周血管转流手术无法立即实施,推荐立即启动AAS伴随脏器灌注不良的处理流程,保障受累脏器的功能支持。(强推荐,证据等级B级)
AAS术前灌注不良综合征与较高的围手术期病死率相关,最高可达43.4%,且呈逐渐上升趋势。AAS继发脏器灌注不良导致死亡随着灌注不良脏器数量的增加而呈线性增加[32-33]。基于较高的围术期病死率及术后并发症高发生率,同时存在如脑灌注受损导致持续昏迷的AAS患者或肠系膜动脉缺血导致严重的肠道缺血(如血便、黑便等)患者不适宜进行外科手术治疗[23],且介入治疗或外周血管转流手术无法立即实施时,推荐立即启动AAS伴随脏器灌注不良的处理流程,具体流程见图 1。
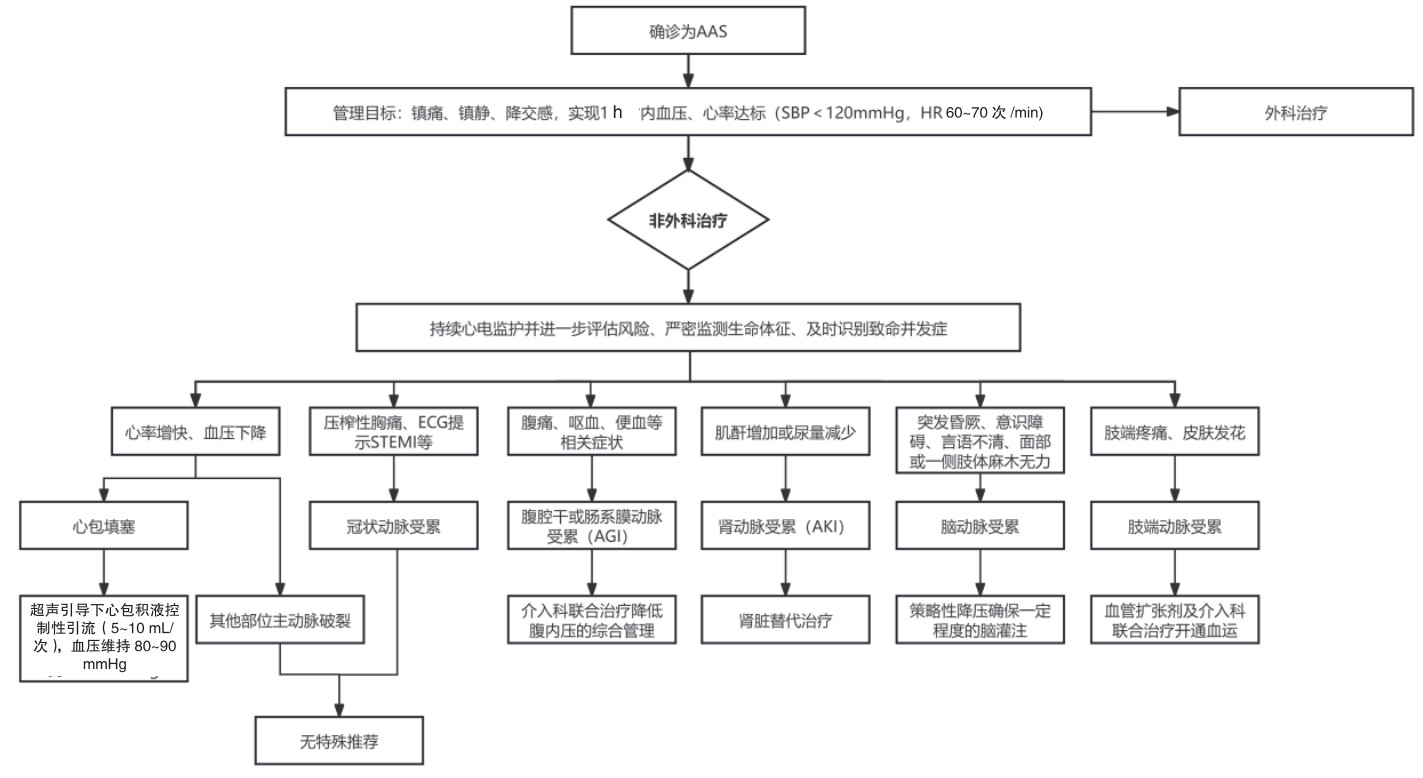
|
| 图 1 AAS非外科强化治疗处理流程 |
|
|
推荐意见8:确诊为AAS的患者,计划接受非外科强化治疗时,若患者发生心包填塞,可尝试给予心包穿刺和限制性心包引流措施。(弱推荐,证据等级C级)
心包填塞是指心包腔内液体(如血液、脓液、渗出液等)异常积聚,导致心包内压力急剧升高,压迫心脏腔室,限制心室舒张期充盈,进而引发血流动力学障碍的急危重症。AAS并发心包填塞发生率约为8%~31%,并发心包填塞患者院内病死率是无心包填塞患者的2倍(54.0% vs. 24.6%)[34-35]。非外科强化治疗过程中,一旦出现心率增快、胸闷加重等症状,伴有血压下降(尤其是出现奇脉为特征性改变)高度提示心包填塞。研究显示限制性心包引流是安全可行的,有助于稳定血流动力学,为进一步转诊或治疗赢得机会[36-37]。Hayashi等[36]采用间歇抽吸法控制引流量,每次抽液5~10 mL,使收缩压维持在80~90 mmHg左右为安全可行的办法。2015年ESC关于心包疾病诊断和处理的指南建议对并发心包填塞的AAS患者,进行控制性心包引流并维持收缩压在90 mmHg左右[37]。心包穿刺应以有创血压监测和中心静脉置管为前提,在超声心动图引导下进行,以最大化降低穿刺风险,稳定患者循环情况。
推荐意见9:确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发脑灌注不良,且介入治疗或外周血管转流手术无法立即实施,当条件允许时推荐依据脑血流、脑电等相关检查判断患者脑缺血程度,并据此调整血压,改善脑灌注。(弱推荐,证据等级B级)
AAS患者会出现不同程度的颈部血管受累,进而累及脑组织灌注。国际急性主动脉夹层登记处(the International Registry of Acute Aortic Dissection, IRAD)的研究显示,急性A型主动脉夹层患者中脑灌注异常的发生率为15%[38]。这些患者可能会表现出无症状、放射影像学异常或深度昏迷。基于缺血性卒中会面临转变为出血性卒中的可能,兼顾有效的压力管理和适当的脑组织灌注至关重要。当介入治疗或外周血管转流手术无法立即实施时,在条件允许时建议通过脑血流、脑电或脑氧监测等相关检查手段,评估脑组织受损和血压调控的阈值,根据实际情况个性化制订控压和扩容策略,以改善脑灌注。同时可以建议采用脑损伤标记物动态观察脑组织受损程度。基层单位暂时不具备相关技术时,可以通过传统的格拉斯哥昏迷评分法(Glasgow coma scale,GCS)来滴定式对血压进行管理。
推荐意见10:确诊为AAS的患者,若发生主动脉破裂、冠脉灌注受损,不推荐实施非外科强化治疗。(弱推荐,证据等级C级)
AAS患者并发主动脉破裂往往在急性期发生,急剧恶化的生命体征多提示有主动脉破裂。当AAS并发冠脉灌注受损时预后极差,住院病死率高达14%~40%,药物保守治疗病死率高达94%,且多数死于严重低心排综合征[39-40],对于此类患者非外科强化治疗管理效果有限。
推荐意见11:确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发腹腔脏器灌注不良综合征,且介入治疗或外周血管转流手术无法立即实施,推荐根据急性胃肠道损伤分级进行对症治疗,并接受多学科团队的综合管理。(推荐等级强推荐,证据等级C级)
组织灌注不良是AAS的严重并发症之一,发生率为15%~40%[30]。外周灌注不良虽然较为少见(脊髓2%~5%,肠系膜4%~6%,肾脏6%~9%),但同样会带来灾难性后果[41]。
AAS患者并发肠缺血(mesenteric Malperfusion,MesMP)是AAS最严重的并发症之一,相关病死率为63.2%[42],最常见的症状为腹痛[3]。IRAD的数据指出,近1/3的继发肠系膜缺血的AAS患者未接受干预治疗,其院内病死率为95%。接受干预的患者通常仅接受药物治疗。相关专家共识指出,肠系膜血管在狭窄达75%的条件下肠道仍可维持12 h近乎无损的状态,但在肠系膜血管完全栓塞的情况下,6 h内即可出现不可逆损伤[29]。对于继发肠系膜缺血的AAS患者,部分中心[42-43]主张在中央主动脉修复术之前,采取早期直接再灌注策略(无论是腔内手术还是开放手术)恢复肠系膜血供。然而,目前对于此类患者的最佳治疗策略仍不完全明确。但如果介入治疗或外周血管转流手术无法立即实施,患者则需要接受由主动脉外科、血管科、急诊科、消化内科、普外科等多学科团队的综合管理。基于此,共识组依据急性肠功能损伤(acute gastrointestinal injury, AGI)的分级制订了相应的处理建议(见表 6[44])。
| 分级 | 定义及表现 | 处理建议a |
| 0 | 无急性胃肠道损伤 | 继续原有药物治疗以确保血压、心率达标;严密观察腹痛、腹胀、肠鸣音等肠缺血症状及体征;推荐自主进食 |
| Ⅰ | 胃肠道功能部分受损,肠鸣音一过性消失48 h后恢复或出现一过性腹泻 | 0级基础上,重新评估营养方式,建议启动肠内营养(1 000~1 500 kcal/d) |
| Ⅱ | 胃肠道功能不能满足代谢需求,需外部干预。可以表现为3 d以上无排便、腹泻、肠内喂养不耐受、腹内压(intra-abdominal pressure,IAP)升高至12~15 mmHg | AGI-Ⅰ级基础上,建议胃肠减压、肛管排气或通便治疗缓解腹腔压力;建议适当减少肠内营养输注速度(减少原有剂量的1/4~1/3),评估营养不良风险,必要时加用静脉营养 |
| Ⅲ | 胃肠道功能完全丧失。表现为肠内喂养不耐受 > 72 h,腹内压升高至15~20 mmHg;肠应激性溃疡 | AGI-Ⅱ级治疗的基础上,依据患者腹内压情况酌情上调AAS患者血压;建议换用短肽类肠内营养制剂,进一步减少输注速度,评估营养不良风险,必要时加用静脉营养 |
| Ⅳ | 病情危及生命,多脏器功能障碍综合征。表现为胃肠道大出血、腹腔室隔综合征 | 无特殊推荐 |
| 注:a所有阶段均需要在AAS进展与维持脏器灌注平衡之间取得平衡 | ||
推荐意见12:确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发急性肾损伤,且介入治疗或外周血管转流手术无法立即实施,推荐根据急性肾损伤程度进行对症治疗,必要时立即实施连续肾脏替代治疗(continuous renal replacement therapy,CRRT),确保内环境稳定。(强推荐,证据等级B级)
当出现少尿、肌酐升高、高钾血症倾向等表现时应考虑到肾动脉受累导致急性肾损伤,此时肾脏替代治疗成为有效维持机体内环境的重要手段。肾损伤标准可参考KDIGO急性肾损伤(acute kidney injury,AKI)分期(见表 7[45])当进入KDIGO AKI分期2期时可考虑进行肾脏替代治疗[46]。值得一提的是,当腹内压升高时采取降低腹内压措施有利于提高部分患者肾动脉的灌注。
| 阶段 | 血清肌酐 | 尿量 | 处理措施 |
| 1 | 基线升高1.5~1.9倍或增加 > 0.3 mg/dl | < 0.5 mL/(kg·h)持续6~12 h | 暂时观察,对症治疗 |
| 2 | 基线升高2.0~2.9倍 | < 0.5 mL/(kg·h)持续 > 12 h | 肾脏替代治疗 |
| 3 | 基线升高≥3倍或 > 4.0 mg/dL或需透析 | < 0.3 mL/(kg·h)持续 > 24 h或无尿 > 12 h | 肾脏替代治疗 |
推荐意见13:确诊为AAS的患者,计划接受非外科强化治疗时,若患者已确诊AAS继发肢体灌注不良综合征,且介入治疗或外周血管转流手术无法立即实施,可尝试应用血管扩张剂,以改善肢体远端的血供。(强推荐,证据等级C级)
AAS患者的肢体缺血通常是由于血管的静态或动态梗阻引起的。在静态梗阻的情况下(通常由髂股血管假腔血栓形成和真腔压迫导致),单纯进行近端主动脉修复往往无法恢复肢体灌注,通常需要采取辅助措施。经过仔细评估后,如果介入治疗或外周血管转流手术无法立即实施,在密切监测下,可以使用血管扩张剂,如前列地尔(10μg配入100 mL生理盐水2 h内静脉滴入,每日2次)、罂粟碱(1 mL: 30 mg配入100 mL生理盐水静脉滴入,1次/3 h)等来改善和恢复肢体远端的血供。
对于血供恢复后的再灌注损伤,可以考虑通过测量筋膜室压力来诊断再灌注后筋膜室综合征。对于血供恢复之后的再灌注损伤,可以通过测量筋膜室压力判断是否存在再灌注后筋膜室综合征[47]。当筋膜室压力显著升高(>30 mmHg)或出现典型的筋膜室综合征表现时(肢体明显肿胀与疼痛、筋膜间隙张力增大、肌肉被动牵拉疼痛、肢体颜色苍白、脉搏减弱、神经功能障碍体征等),应立即行筋膜切开术[48]。
推荐意见14:持续接受非外科强化治疗的AAS患者,度过急性期(14 d)后,若患者具备手术指征、无手术禁忌,仍推荐外科治疗;若外科治疗无法实施,推荐维持规律生命体征监测与疾病健康管理。(强推荐,证据等级B级)
所有确诊为AAS的患者,通过非外科强化治疗度过急性期(14 d)后,对于具备手术指征的患者,若无手术禁忌,仍推荐外科治疗。若外科治疗无法实施,应维持规律监测生命体征平稳。对于高血压患者,继续巩固降压治疗以减少不良事件的发生[1],包括β-受体阻滞剂、非二氢吡啶类钙拮抗剂、血管紧张素转换酶抑制剂(ACEI)等。除了主要通过舒张血管进行降压的药物(如肼苯哒嗪、米诺地尔)以及具有内在拟交感活性的β-受体阻滞剂(醋丁洛尔、吲哚洛尔),几乎所有联合降压方案都可以选择。对所有AAS患者推荐每天至少三次监测血压、心率。建议于出院前、3个月、6个月、12个月复查主动脉CTA和经胸超声心动图。之后每1~2年复查一次主动脉CTA和经胸超声心动图进行评估。接受非外科强化保守治疗的AAS患者应在医生指导下进行适度的康复锻炼,避免剧烈体力活动。
推荐意见15:确诊为AAS的患者,计划接受非外科强化治疗时,可尝试根据既往基础研究或转化研究的证据,开展相应的临床治疗,提高非外科强化治疗的疗效。(推荐等级强推荐,证据等级C级)
目前,针对主动脉疾病的发生发展机制众说纷纭,国内外众多团队均在尝试根据基础研究提供的方向,探索通过药物途径治疗AAS患者,力图改善其预后。有研究提示线粒体功能障碍引发的血管平滑肌细胞表型转化是主动脉夹层病理生理机制的核心环节。辅酶Q10作为线粒体膜稳定剂,可通过维持线粒体膜电位及改善氧化磷酸化功能显著降低实验性小鼠主动脉夹层模型的病死率[49]。酮咯酸作为一种非甾体抗炎药和Rho GTPase信号通路抑制剂,可以降低动物模型中主动脉疾病的进展、发病率和严重程度[50],在此基础上,南京鼓楼医院尝试对接受主动脉夹层手术的患者使用酮咯酸,以评估其在改善急性A型主动脉夹层预后方面的安全性和有效性[51]。mTOR抑制剂雷帕霉素,也被报道在小鼠模型中能有效预防AD的发生,并且能抑制AD的恶化[52-53]。有研究表明纤维蛋白原水平的降低与TAAD患者预后不良相关,可以予患者外源性的纤维蛋白原以改善此类情况[54]。依据既往基础研究或转化研究的证据,可以尝试开展相应的临床治疗,提高非外科强化治疗的疗效,有助于进一步提升对AAS的综合救治能力。
4 其他 4.1 局限性本共识仅限于医学专业人员参考,推荐意见制定主要基于专家临床经验及传统实践模式,未系统纳入患者意愿与价值取向调查,存在潜在选择偏倚与适用性局限。
4.2 特殊亚组人群考虑本共识针对继发灌注不良综合征的AAS患者及继发灌注不良综合征且介入治疗或外周血管转流手术无法立即实施的AAS患者的处理提供了推荐意见。
4.3 共识发表与更新计划为了广泛传播和推广本共识的内容,本共识将于多期刊同期发表。随着未来更多高质量随机对照试验(RCT)的发表、真实世界数据的不断补充以及基础医学药物研发的加速转化,本共识将依据新的科学证据、临床实践的变化以及反馈意见,适时进行必要的修订与更新,确保本共识始终紧跟医学前沿,为临床决策提供科学、精准且实用的指导,进而促进医疗质量的稳步提升和患者预后的持续改善,推动整个医学领域的进步与发展。
4.4 具体应用本共识针对AAS的非外科强化治疗策略展开深入探讨。在诊疗流程中,心脏大血管外科医生与急诊科医生作为初始评估与干预的核心力量,肩负着关键职责;危重症医学科、外周血管科、神经内科、消化内科、肾内科、骨科等学科则作为重要的协同诊疗单位,全程参与。基于此,我们强烈建议在AAS治疗中尽早启动多学科团队协作治疗模式,以提升治疗效果与患者预后。同时,推荐各级医疗机构以本共识所列推荐条目为重要参考依据,紧密结合自身实际医疗条件,全面、综合地评估并制定出最优的治疗方案,确保患者能够得到最为恰当、及时的医疗救治。
共识执笔:姜文剑米玉红戴路朱尹凡陆艳辉吴昊天王世攀方舟梁嘉俊
制定专家:张宏家(首都医科大学附属北京安贞医院)姜文剑(首都医科大学附属北京安贞医院)米玉红(首都医科大学附属北京安贞医院)孙立忠(上海德达医院)朱俊明(首都医科大学附属北京安贞医院)刘永民(首都医科大学附属北京安贞医院)王晓龙(首都医科大学附属北京安贞医院)里程楠(首都医科大学附属北京安贞医院)刘愚勇(安徽医科大学附属第一医院)区景松(中山大学附属第一医院)陆艳辉(首都医科大学附属北京安贞医院)王美丽(首都医科大学基础医学院)赵远斐(北京市心肺血管疾病研究所)
审核专家(按姓名笔画排序):于存涛(中国医学科学院阜外医院)马青变(北京大学第三医院)马量(浙江大学医学院附属第一医院)马瑞彦(陆军军医大学第二附属医院)王正军(山东医科大学附属省立医院)王东进(南京鼓楼医院)王春生(复旦大学附属中山医院)朱长举(郑州大学第一附属医院)朱华栋(北京协和医院)朱继红(北京大学人民医院)刘宁宁(山西心血管病医院)刘笑然(海南医科大学急诊创伤学院)闫炀(西安交通大学第一附属医院)孙图成(广东省人民医院)孙晓刚(中国医学科学院阜外医院)李亚雄(昆明延安医院)李培武(兰州大学第二医院)杨艳敏(中国医学科学院阜外医院)肖颖彬(重庆陆军军医大学附属第二医院心血管外科)吴永兵(南昌大学第二附属医院)谷天祥(中国医科大学附属第一医院)张成鑫(安徽医科大学附属第一医院)张国强(中日友好医院)张剑锋(广西医科大学附属武鸣医院)张斯龙(中华急诊医学杂志)陈庆良(天津胸科医院)陈良万(福建医科大学附属协和医院)邵永丰(江苏省人民医院)范瑞新(广东省心血管病研究所)罗明尧(中国医学科学院阜外医院)周建(海军军医大学第三附属医院)郑宝石(广西医科大学第一附属医院)胡北(广东省人民医院)胡行健(华中科技大学附属协和医院)胡佳(四川大学华西医院)柳克祥(吉林大学第二医院)段维勋(空军军医大学第一附属医院)柴艳芬(天津医科大学总医院)徐峰(山东大学齐鲁医院)郭伟(东直门中医医院)黄凌瑾(中南大学湘雅医院)曹钰(四川大学华西医院)崇巍(中国医科大附属一院)董士民(河北医科大学第三附属医院)董念国(华中科技大学附属协和医院)韩小彤(湖南省人民医院)程兆云(阜外华中心血管病医院)谢苗荣(首都医科大学附属北京友谊医院)赖颢(复旦大学附属中山医院)燕宪亮(徐州医科大学)
利益冲突 所有作者声明无利益冲突
| [1] | Isselbacher EM, Preventza O, Black JH 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American heart association/American college of cardiology joint committee on clinical practice guidelines[J]. Circulation, 2022, 146(24): e334-e482. DOI:10.1161/CIR.0000000000001106 |
| [2] | Clouse WD, Hallett JW, Schaff HV, et al. Acute aortic dissection: population-based incidence compared with degenerative aortic aneurysm rupture[J]. Mayo Clin Proc, 2004, 79(2): 176-180. DOI:10.4065/79.2.176 |
| [3] | Howard DPJ, Banerjee A, Fairhead JF, et al. Population-based study of incidence and outcome of acute aortic dissection and premorbid risk factor control: 10-year results from the Oxford Vascular Study[J]. Circulation, 2013, 127(20): 2031-2037. DOI:10.1161/CIRCULATIONAHA.112.000483 |
| [4] | Mody PS, Wang Y, Geirsson A, et al. Trends in aortic dissection hospitalizations, interventions, and outcomes among medicare beneficiaries in the United States, 2000-2011[J]. Circ Cardiovasc Qual Outcomes, 2014, 7(6): 920-928. DOI:10.1161/CIRCOUTCOMES.114.001140 |
| [5] | Melvinsdottir IH, Lund SH, Agnarsson BA, et al. The incidence and mortality of acute thoracic aortic dissection: results from a whole nation study[J]. Eur J Cardiothorac Surg, 2016, 50(6): 1111-1117. DOI:10.1093/ejcts/ezw235 |
| [6] | Yamaguchi T, Nakai M, Yano T, et al. Population-based incidence and outcomes of acute aortic dissection in Japan[J]. Eur Heart J Acute Cardiovasc Care, 2021, 10(7): 701-709. DOI:10.1093/ehjacc/zuab031 |
| [7] | Gouveia e Melo R, Mourão M, Caldeira D, et al. A systematic review and meta-analysis of the incidence of acute aortic dissections in population-based studies[J]. J Vasc Surg, 2022, 75(2): 709-720. DOI:10.1016/j.jvs.2021.08.080 |
| [8] | Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2014, 35(41): 2873-2926. DOI:10.1093/eurheartj/ehu281 |
| [9] | Hirst AE Jr, Johns VJ Jr, Kime SW Jr. Dissecting aneurysm of the aorta: a review of 505 cases[J]. Medicine (Baltimore), 1958, 37(3): 217-279. DOI:10.1097/00005792-195809000-00003 |
| [10] | Wilson King R, Bonaca MP. Acute aortic syndromes: a review of what we know and future considerations[J]. Eur Heart J Acute Cardiovasc Care, 2021, 10(10): 1197-1203. DOI:10.1093/ehjacc/zuab106 |
| [11] | Vignaraja V, Sharma S, Dindyal S. Acute aortic syndrome[M]. StatPearl Publishing, 2025. |
| [12] | Sorber R, Hicks CW. Diagnosis and management of acute aortic syndromes: dissection, penetrating aortic ulcer, and intramural hematoma[J]. Curr Cardiol Rep, 2022, 24(3): 209-216. DOI:10.1007/s11886-022-01642-3 |
| [13] | Ankola DD, Viswanad B, Bhardwaj V, et al. Development of potent oral nanoparticulate formulation of coenzyme Q10 for treatment of hypertension: can the simple nutritional supplements be used as first line therapeutic agents for prophylaxis/therapy?[J]. Eur J Pharm Biopharm, 2007, 67(2): 361-369. DOI:10.1016/j.ejpb.2007.03.010 |
| [14] | Bossone E, Pyeritz RE, O'Gara P, et al. Acute aortic dissection in blacks: insights from the international registry of acute aortic dissection[J]. Am J Med, 2013, 126(10): 909-915. DOI:10.1016/j.amjmed.2013.04.020 |
| [15] | Bossone E, LaBounty TM, Eagle KA. Acute aortic syndromes: diagnosis and management, an update[J]. Eur Heart J, 2018, 39(9): 739-749d. DOI:10.1093/eurheartj/ehx319 |
| [16] | Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations[J]. BMJ, 2008, 336(7650): 924-926. DOI:10.1136/bmj.39489.470347.AD |
| [17] | 陈耀龙, 杨克虎, 王小钦, 等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志, 2022, 102(10): 697-703. DOI:10.3760/cma.j.cn112137-20211228-02911 |
| [18] | GB/T 1.1—2020《标准化工作导则第1部分: 标准化文件的结构和起草规则》标准解读[J]. 机械工业标准化与质量, 2020(11): 22-26, 36. |
| [19] | Evangelista A, Isselbacher EM, Bossone E, et al. Insights from the international registry of acute aortic dissection: a 20-year experience of collaborative clinical research[J]. Circulation, 2018, 137(17): 1846-1860. DOI:10.1161/CIRCULATIONAHA.117.031264 |
| [20] | Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine[J]. Circulation, 2010, 121(13): e266-369. DOI:10.1161/CIR.0b013e3181d4739e |
| [21] | Liu LW, Cui YK, Zhang L, et al. Effectiveness of chest pain center accreditation on the hospital outcome of acute aortic dissection: a nationwide study in China[J]. Mil Med Res, 2024, 11(1): 62. DOI:10.1186/s40779-024-00565-0 |
| [22] | Bossone E, Eagle KA, Nienaber CA, et al. Acute aortic dissection: observational lessons learned from 11 000 patients[J]. Circ Cardiovasc Qual Outcomes, 2024, 17(9): e010673. DOI:10.1161/CIRCOUTCOMES.123.010673 |
| [23] | Aboyans V, Boukhris M. Dissecting the epidemiology of aortic dissection[J]. Eur Heart J Acute Cardiovasc Care, 2021, 10(7): 710-711. DOI:10.1093/ehjacc/zuab065 |
| [24] | Pape LA, Awais M, Woznicki EM, et al. Presentation, diagnosis, and outcomes of acute aortic dissection: 17-year trends from the international registry of acute aortic dissection[J]. J Am Coll Cardiol, 2015, 66(4): 350-358. DOI:10.1016/j.jacc.2015.05.029 |
| [25] | Wang DD, Zhang H, Du LF, et al. Early prediction model of acute aortic syndrome mortality in emergency departments[J]. Int J Gen Med, 2022, 15: 3779-3788. DOI:10.2147/IJGM.S357910 |
| [26] | Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit[J]. Crit Care Med, 2013, 41(1): 263-306. DOI:10.1097/CCM.0b013e3182783b72 |
| [27] | Shahu AD, Banna S, Applefeld W, et al. Liberation from mechanical ventilation in the cardiac intensive care unit[J]. JACC Adv, 2023, 2(1): 100173. DOI:10.1016/j.jacadv.2022.100173 |
| [28] | Guan XL, Li L, Lu XR, et al. Safety and efficacy of fibrinogen concentrate in aortic arch surgery involving moderate hypothermic circulatory arrest[J]. J Thromb Thrombolysis, 2023, 55(1): 67-73. DOI:10.1007/s11239-022-02706-5 |
| [29] | 中国医师协会急诊医师分会, 解放军急救医学专业委员会, 中华医学会急诊医学分会, 等. 2020年中国急性肠系膜缺血诊断与治疗专家共识[J]. 中华急诊医学杂志, 2020, 29(10): 1273-1281. DOI:10.3760/cma.j.issn.1671-0282.2020.10.003 |
| [30] | Christopher Malaisrie S, Szeto WY, Halas M, et al. 2021 The American Association for Thoracic Surgery expert consensus document: Surgical treatment of acute type A aortic dissection[J]. J Thorac Cardiovasc Surg, 2021, 162(3): 735-758. DOI:10.1016/j.jtcvs.2021.04.053 |
| [31] | 中华医学会外科学分会血管外科学组. 下肢动脉硬化闭塞症诊治指南(上)[J]. 中国血管外科杂志(电子版), 2015, 7(3): 145-151. DOI:10.3969/j.issn.1674-7429.2015.03.005 |
| [32] | Wolfe SB, Sundt TM 3rd, Isselbacher EM, et al. Survival after operative repair of acute type A aortic dissection varies according to the presence and type of preoperative malperfusion[J]. J Thorac Cardiovasc Surg, 2024, 168(1): 37-49. DOI:10.1016/j.jtcvs.2022.09.034 |
| [33] | Geirsson A, Szeto WY, Pochettino A, et al. Significance of malperfusion syndromes prior to contemporary surgical repair for acute type A dissection: outcomes and need for additional revascularizations[J]. Eur J Cardiothorac Surg, 2007, 32(2): 255-262. DOI:10.1016/j.ejcts.2007.04.012 |
| [34] | 祝明华, 江寅芳, 胡坚, 等. 主动脉夹层并心包填塞术前诊疗策略分析[J]. 中华急诊医学杂志, 2020, 29(5): 732-735. DOI:10.3760/cma.j.issn.1671-0282.2020.05.025 |
| [35] | Cruz I, Stuart B, Caldeira D, et al. Controlled pericardiocentesis in patients with cardiac tamponade complicating aortic dissection: experience of a centre without cardiothoracic surgery[J]. Eur Heart J Acute Cardiovasc Care, 2015, 4(2): 124-128. DOI:10.1177/2048872614549737 |
| [36] | Hayashi T, Tsukube T, Yamashita T, et al. Impact of controlled pericardial drainage on critical cardiac tamponade with acute type A aortic dissection[J]. Circulation, 2012, 126(11 Suppl 1): S97-S101. DOI:10.1161/CIRCULATIONAHA.111.082685 |
| [37] | Adler Y, Charron P, Imazio M, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC)Endorsed by: The European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur Heart J, 2015, 36(42): 2921-2964. DOI:10.1093/eurheartj/ehv318 |
| [38] | Sultan I, Bianco V, Patel HJ, et al. Surgery for type A aortic dissection in patients with cerebral malperfusion: Results from the International Registry of Acute Aortic Dissection[J]. J Thorac Cardiovasc Surg, 2021, 161(5): 1713-1720. DOI:10.1016/j.jtcvs.2019.11.003 |
| [39] | Tang YF, Zhang GX, Liao ZL, et al. Surgical treatment of coronary malperfusion with acute type A aortic dissection[J]. Chin Med J, 2016, 129(8): 1000-1002. DOI:10.4103/0366-6999.179797 |
| [40] | Hashimoto O, Saito Y, Sasaki H, et al. Treatment strategies and in-hospital mortality in patients with type A acute aortic dissection and coronary artery involvement[J]. J Thorac Cardiovasc Surg, 2024, 167(2): 596-601. DOI:10.1016/j.jtcvs.2022.03.016 |
| [41] | Md EI, Md BR, Md MR, et al. Management of malperfusion: New York approach and outcomes[J]. J Card Surg, 2021, 36(5): 1757-1765. DOI:10.1111/jocs.15025 |
| [42] | Berretta P, Trimarchi S, Patel HJ, et al. Malperfusion syndromes in type A aortic dissection: what we have learned from IRAD[J]. J Vis Surg, 2018, 4: 65. DOI:10.21037/jovs.2018.03.13 |
| [43] | Leshnower BG, Keeling WB, Duwayri YM, et al. The "thoracic endovascular aortic repair-first" strategy for acute type A dissection with mesenteric malperfusion: Initial results compared with conventional algorithms[J]. J Thorac Cardiovasc Surg, 2019, 158(6): 1516-1524. DOI:10.1016/j.jtcvs.2019.01.116 |
| [44] | Berger MM, Hurni CA. Management of gastrointestinal failure in the adult critical care setting[J]. Curr Opin Crit Care, 2022, 28(2): 190-197. DOI:10.1097/mcc.0000000000000924 |
| [45] | Lopes JA, Jorge S. The RIFLE and AKIN classifications for acute kidney injury: a critical and comprehensive review[J]. Clin Kidney J, 2013, 6(1): 8-14. DOI:10.1093/ckj/sfs160 |
| [46] | 国家慢性肾病临床医学研究中心, 中国医师协会肾脏内科医师分会, 中国急性肾损伤临床实践指南专家组, 等. 中国急性肾损伤临床实践指南[J]. 中华医学杂志, 2023, 103(42): 3332-3366. DOI:10.3760/cma.j.cn112137-20230802-00133 |
| [47] | Björck M, Earnshaw JJ, Acosta S, et al. Editor's choice–European society for vascular surgery (ESVS) 2020 clinical practice guidelines on the management of acute limb ischaemia[J]. Eur J Vasc Endovasc Surg, 2020, 59(2): 173-218. DOI:10.1016/j.ejvs.2019.09.006 |
| [48] | 中华医学会骨科学分会外固定与肢体重建学组, 中国医师协会创伤外科医师分会创伤感染专业委员会, 中国医师协会骨科医师分会创伤专家工作委员会. 中国急性骨筋膜室综合征早期诊断与治疗指南(2020版)[J]. 中华创伤骨科杂志, 2020, 22(8): 645-654. DOI:10.3760/cma.j.cn115530-20200715-00467 |
| [49] | Luo YT, Luo JJ, An P, et al. The activator protein-1 complex governs a vascular degenerative transcriptional programme in smooth muscle cells to trigger aortic dissection and rupture[J]. Eur Heart J, 2024, 45(4): 287-305. DOI:10.1093/eurheartj/ehad534 |
| [50] | Nejim B, Libby Weaver M, Locham S, et al. Intravenous ketorolac is associated with reduced mortality and morbidity after open abdominal aortic aneurysm repair[J]. Vascular, 2021, 29(1): 15-26. DOI:10.1177/1708538120914454 |
| [51] | Lv ZK, Pan T, Zhang HT, et al. Safety and efficacy of ketorolac in improving the prognosis of acute type A aortic dissection patients: a protocol of a randomized, double-blinded, and placebo-controlled study[J]. Trials, 2024, 25(1): 250. DOI:10.1186/s13063-024-08093-x |
| [52] | Hayashi-Hori M, Aoki H, Matsukuma M, et al. Therapeutic effect of rapamycin on aortic dissection in mice[J]. Int J Mol Sci, 2020, 21(9): 3341. DOI:10.3390/ijms21093341 |
| [53] | Zhou B, Li W, Zhao GZ, et al. Rapamycin prevents thoracic aortic aneurysm and dissection in mice[J]. J Vasc Surg, 2019, 69(3): 921-932. DOI:10.1016/j.jvs.2018.05.246 |
| [54] | Samanidis G, Kolovou K, Kanakis M, et al. Outcomes of patients with postoperative acute kidney injury after acute type A aortic dissection repair[J]. J Pers Med, 2025, 15(1): 9. DOI:10.3390/jpm15010009 |
 2025, Vol. 34
2025, Vol. 34