2. 麻省理工学院医学工程与科学学院,波士顿 02139
在医疗领域,急危重症对患者生命构成了严峻且直接的威胁,这主要归因于疾病本身高度的复杂性、多样性与不确定性[1]。急危重症涵盖的疾病种类繁多,每种疾病的发病机制极为复杂,涉及多系统、多层面的生理病理改变,其临床表现也呈现出显著差异,不同疾病之间症状、体征、病程进展各具特点。此外,年龄、基础疾病、生理状态等个体差异,使不同患者对同一疾病的病理反应和治疗效果不尽相同,呈现出高度的异质性。急危重症患者病情变化迅速,往往在短时间内即可发生急剧恶化,从相对稳定状态迅速进展至生命垂危。
随着现代信息技术的飞速发展,特别是人工智能(artificial intelligence, AI)、大数据、云计算等新兴技术在各领域的广泛渗透,医疗健康行业正经历着深刻的数字化变革[2]。值得注意的是,2023年以来的生成式AI革命为急危重症诊疗带来新机遇[3],以Transformer架构为基础的大语言模型不仅能处理结构化数据,更能理解临床文本、影像报告等非结构化数据,其多模态融合能力在复杂场景中展现出突破性潜力。医学AI通过构建先进的智能诊断模型,模拟人类医生的临床思维逻辑,能够快速、准确地对急危重症患者的病情进行评估与判断[4]。与传统判别式模型相比,生成式架构通过自注意力机制实现跨模态特征交互,更适应急诊环境的时序密集性、信息碎片化、决策紧迫性的特点,有助于改善患者预后[5]。2025年政府工作报告明确提出持续推进“人工智能+”行动,通过政策引导和资金支持,将推动AI技术在医疗等领域的深度融合与创新应用。
医学AI在急危重症领域展现出巨大的应用潜力,并在特定场景和实验环境下取得了显著成果,但在实际临床应用中仍面临诸多挑战[6-7](图 1)。这些问题制约了医学AI在急危重症领域的深入发展和全面推广,因此深入研究并探索有效的应对策略具有重要的现实意义。
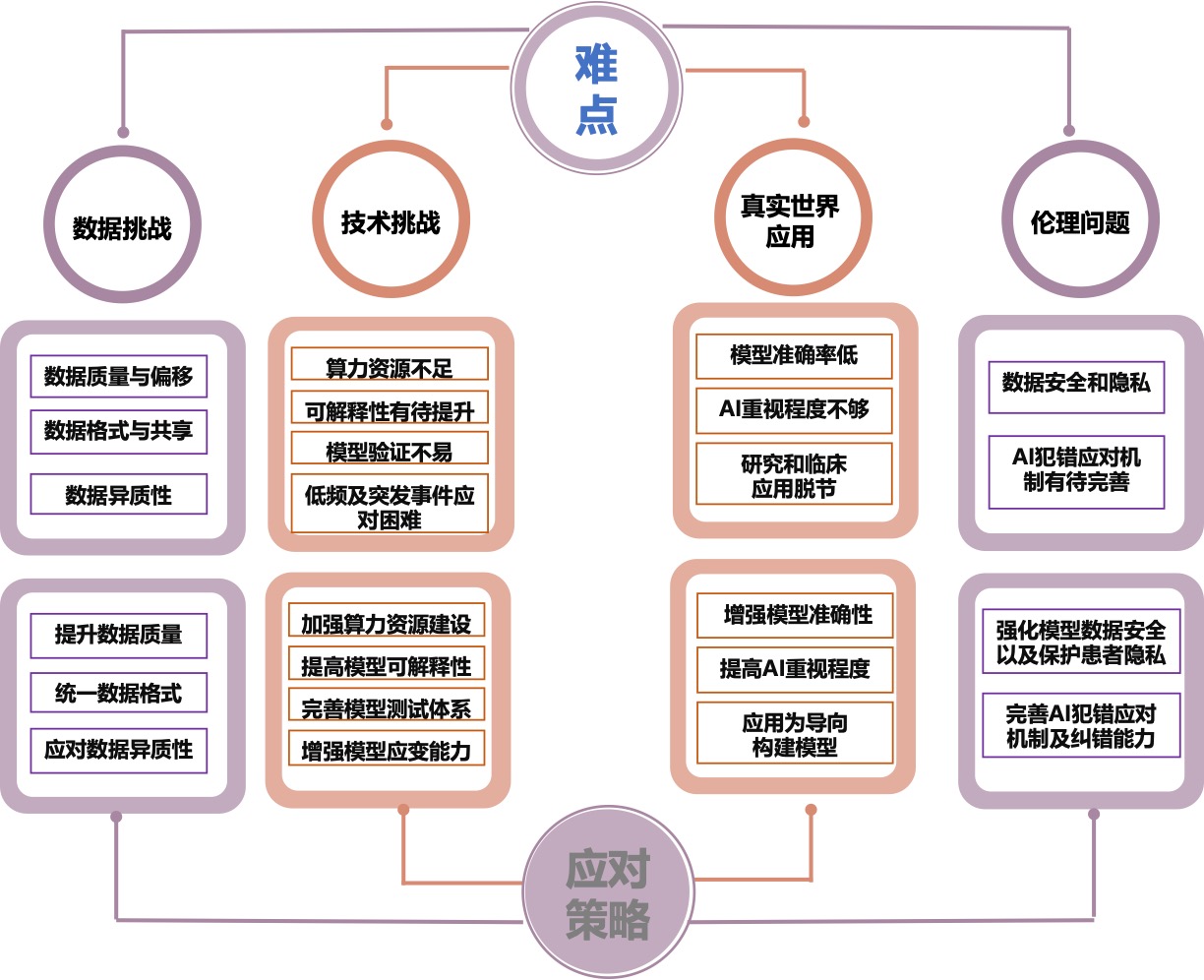
|
| 图 1 医学AI在急危重症应用中的难点及对策 |
|
|
医疗数据质量的优劣直接关系到医学AI分析结果的准确性与临床决策的可靠性[8]。从质量评估维度来看,需首先验证数据的逻辑合理性:临床医师在数据录入环节可能由于操作疏忽或电子病历系统设计缺陷,导致异常数据未能被有效识别和拦截。另一方面,在跨系统数据交互过程中,由于标准化程度不足(如检验项目计量单位在mg/dL与mmol/L之间混用),会造成实验室检测数据与临床诊断结论之间的逻辑关联性缺失。此外,电子健康记录系统更新的滞后性,使得数据时效性无法及时反映患者当前的病情变化,影响了基于数据的诊疗决策的及时性。更深层的挑战在于数据的代表性:当模型训练依赖的公开数据与目标人群的种族、地域或疾病谱分布存在显著差异时,其生成的诊疗建议可能系统性偏离真实场景需求。例如针对急危重症的液体复苏的动态诊疗策略,目前主要基于欧美人群的生理参数训练,在亚洲患者中可能出现液体复苏阈值误判等风险[9]。
数据库架构若不合理,会造成数据可用性差,导致提取和利用数据困难。数据完整性存在诸多问题,例如字段缺失、数据丢失等情况屡见不鲜,增加了数据处理的复杂性,降低了数据分析结果的质量和可信度[10]。此外,急危重症数据具有强时空关联性,传统静态数据集无法满足生成式大模型的训练需求。这些问题都会严重阻碍医学AI对急危重症的准确判断和有效处理。
1.1.2 数据格式与共享当前,急危重症数据标准化缺失已成为智能辅助决策的隐形瓶颈。当前,医疗机构的信息系统在数据采集与存储环节面临显著的标准与架构异质性,例如USCDI(United States Core Data for Interoperability)的数据元素定义不一致,导致数据集成的互操作性受限。在数据传输环节,由于协议规范约束,如FHIR(Fast Healthcare Interoperability Resources)接口的调用频率不足,数据实时交互效率受到影响。此外,在数据交换环节,信任框架的延迟认证问题,包括TEFCA(Trusted Exchange Framework and Common Agreement)合规性核验耗时较长,进一步加剧了跨机构数据共享的挑战,这些混乱的局面形成了一个个“数据孤岛”[11]。这一问题在急危重症救治中尤为突出——分秒必争的抢救过程中,数据整合障碍直接威胁患者生存率。即便在单一医疗机构内,急危重症数据仍呈现碎片化分布,急诊抢救室的实时生命体征监测数据、影像科的DICOM文件、ICU监护系统的监测参数往往被封闭在各自独立的数据库中。数据在不同系统之间难以自由流通和共享,极大地限制了医学AI对多源数据的整合与分析能力,使临床决策支持系统在”黄金抢救时间”内无法获取完整、准确的病情信息,削弱了其在生死攸关时刻的辅助决策价值。
数据孤岛效应不仅阻碍多源数据整合,更使得医学AI模型普遍面临小样本训练的困境[12],影响了对急危重症患者的精准诊疗。尤其对于罕见急症,跨机构数据共享的缺失导致单个医疗中心年均病例不足,迫使AI模型依赖合成数据生成,进一步放大预测偏差风险[13]。
1.1.3 数据异质性在医疗AI领域,数据异质性主要表现为两种形式:一是结构性异质性,指数据在属性、类型、格式等方面的差异性;二是概念性异质性,指相同医学术语在不同时期或场景下的内涵演变。本研究重点关注后者对急危重症AI模型的特殊影响。
临床医学知识体系处于动态进化过程中,每年有大量诊断标准、治疗指南和病理机制认知被更新,而AI模型的训练数据往往滞后于最新医学进展。例如脓毒症诊断标准近年来多次调整,从全身炎症反应综合征(systemic inflammation response syndrome, SIRS)评分到序贯器官衰竭(sequential organ failure assessment, SOFA)评分系统的演变直接改变了关键生物标志物的权重,但依赖历史数据训练的模型仍固守旧有特征关联模式,导致对急危重症患者的风险分层出现系统性偏差[14]。
疾病表型的时空变异特性进一步放大数据时效性危机。以新型冠状病毒为例,不同变异株导致的临床症状谱、实验室检查特征和疾病进展规律均发生显著改变,早期疫情阶段训练的预警模型无法识别新变异株引发的“沉默性低氧血症”等非典型临床表现。更为严峻的挑战来自全新疾病的突发性出现——当训练数据完全缺失某类疾病时,生成式大模型可能错误套用相似病症的诊疗逻辑,例如将未知病原体引发的急性呼吸衰竭误判为细菌性肺炎,从而推荐不恰当的抗感染治疗方案[15]。
1.2 技术挑战 1.2.1 算力资源不足急危重症救治对AI系统的响应速度和稳定性提出了很高要求,然而基础设施不足已成为制约其发展的重要瓶颈。多数急诊科和ICU单元的计算基础设施无法满足急重症急救AI模型的高算力需求,导致在抢救黄金时间内模型反应迟缓。特别是在基层急救网点和中小型医疗机构,硬件设施的短板更为明显,无法支持复杂疾病状态下的实时AI辅助决策,影响了危急患者的抢救效率。
算力不足导致模型训练时间漫长,无法及时迭代更新以适应临床需求。此外,急危重症AI人才短缺问题更加突出,因为此类系统不仅要求开发团队精通计算机科学和数学算法,还需深谙重症医学、急诊抢救和危急情况处理流程。这类能在生死时速中精准应用AI技术的复合型人才团队匮乏,直接限制了急危重症智能决策系统在抢救一线的实际应用效果。
1.2.2 可解释性有待提升在医学领域,诊疗决策关乎患者的生命安全,要求具备高度的可解释性。当前,多数深度学习模型属于“黑箱”模型,其内部决策过程复杂且难以理解。医生在使用AI辅助决策时,无法清晰知晓模型做出诊断或治疗建议的依据和逻辑[5, 7]。这在多器官功能衰竭、休克等复杂急症中尤为突出。医生面对危急患者需在分秒间做出判断,却无法获知AI推荐特定治疗方案的具体依据,这使得医生对AI辅助决策心存顾虑,不敢完全依赖AI技术,从而阻碍了其在临床中的广泛应用。
1.2.3 模型验证不易医学AI模型的可靠性直接关系到患者的生命安全,因此必须进行严格的验证和测试。然而,急危重症病例具有特殊性,其病情复杂多变、个体差异大,开展大规模、多中心的临床试验面临诸多困难。不同医疗环境下的设备、技术水平、医护人员操作习惯等存在差异,这些因素都会影响模型的性能表现[16]。
采用回顾性数据验证又难以准确模拟真实抢救场景中的时间压力和资源限制。如何在保障患者安全的前提下,科学验证AI模型在急诊休克、心脏骤停、急性呼吸衰竭等危急情况下的准确性和可靠性,成为决定这些技术能否真正应用于挽救生命的关键问题。
1.2.4 低频及突发事件应对困难急危重症疾病模式的动态演变对AI系统的快速适应能力提出了严峻考验。急危重症患者的病情波动远超常规患者,同时新型传染病、创伤模式和中毒类型不断涌现,传统AI系统缺乏对这些新型急危重症数据趋势的捕捉和分析能力。AI系统若不能及时捕捉和分析这些新的数据趋势,就难以及时调整模型以适应疾病的变化。例如,在流感高发季节,病毒可能发生变异,导致疾病的症状和传播方式改变,而AI系统如果不能快速识别这些变化,就可能无法准确诊断和预测病情,延误患者的治疗时机[17]。因此,提高AI系统对新数据流行趋势的识别能力,是应对急危重症疾病变化的关键所在。
1.3 真实世界应用问题 1.3.1 模型准确率低在急危重症救治场景中,AI模型的诊断敏感度和特异度波动显著削弱临床信任。面对复杂多变的急性病理生理改变(如循环衰竭代偿期向失代偿期过渡、多器官功能障碍的级联效应),AI系统对关键转折点的识别滞后可能延误黄金抢救窗口,带来不可挽回的临床后果。当前模型在处理急危重症的动态变化和多系统交互影响时表现出的局限性尤为明显。
急危重症的异质性挑战尤为突出——不同医院的治疗规范各异、不同患者的基础疾病谱系复杂、区域医疗资源配置不均衡,这些因素共同构成了模型泛化的障碍。大部分急危重症呈现明显的病理生理异质性,同一诊断下的不同患者可能有截然不同的表现形式和进展轨迹,导致模型难以建立稳定可靠的预测规则[18]。医疗数据的固有问题,如结构化数据的完整性不足、非结构化数据的标准化缺失、临床记录的主观性和偏差等,进一步降低了模型的可重复性和可靠性。此外,数据的质量参差不齐和数量分布不均、建模方法的选择偏好、以及模型架构的固有局限,都会显著影响模型性能的跨中心一致性。
1.3.2 培训资源不足现有AI培训体系与急危重症临床需求存在结构性脱节,医疗人员对AI技术的了解程度普遍不足。虽然医护人员具备扎实的临床专业知识,但对AI如何赋能急危重症救治缺乏系统认知,导致在实际应用中难以有效利用AI工具提供决策支持。急救技能教学中缺乏AI辅助设备的情景化整合,使医护人员难以掌握动态监测数据与AI实时反馈的联动逻辑。
1.3.3 模型与临床配合度低目前医学模型的研究与临床应用存在显著脱节。研究人员倾向于选择数据易获取、问题界定明确的课题,而非临床最迫切需要解决的复杂问题,导致许多模型虽具学术价值,却难以满足一线救治需求。模型设计缺乏临床实用性考量,操作界面复杂、输出结果难以解读、与工作流程融合不足,使临床医生在紧急情况下难以高效应用。
临床模型数量不足,缺乏系统性规划,没有形成覆盖急危重症主要决策点的完整体系。目前模型多集中于某些特定疾病(如脑卒中、冠心病),而对多器官功能衰竭、复杂创伤等综合性问题的AI辅助决策研究明显不足。这种碎片化、非系统性的模型研发难以形成合力,使得临床问题普遍不能得到全面解决。
1.4 伦理问题 1.4.1 数据安全和隐私医疗数据包含患者大量敏感信息,如个人身份、健康状况、疾病史等。一旦这些数据泄露,可能导致患者隐私被滥用,给患者带来精神压力和潜在的经济损失,同时也会严重影响公众对医疗数据共享的信任[19]。在数据存储与处理过程中,医疗信息系统的安全防护能力参差不齐,部分医疗机构缺乏专业的数据安全团队和完备的技术防护措施。云计算环境下的数据跨境流动更增加了监管难度和泄露风险。
1.4.2 AI犯错应对机制缺失在医学AI的应用过程中,当出现诊断或治疗建议错误时,目前犯错应对机制有待完善。这一问题在急危重症领域表现得尤为突出,因为在这类时间紧迫、病情复杂的场景中,AI辅助决策的失误可能直接威胁患者生命安全。
现有医学AI系统普遍缺乏有效的错误检测与纠错机制。与人类医生能够通过经验和临床思维识别异常情况不同,AI系统难以有效识别和纠正自身错误,在面对超出训练数据范围的情况时,既不能主动识别认知局限,也难以通过持续学习更新知识。与传统AI相比,大语言模型更容易产生“幻觉”现象,在数据不足或矛盾的情况下仍可能生成看似合理但完全错误的判断,且缺乏明确的不确定性提示。
特别是在面对临床罕见病例或数据分布外的情况时,模型可能产生高置信度但完全错误的结果,而没有明确的警示信号提醒使用者。当AI系统给出错误建议后,系统通常无法从这些错误中学习并自动更新,导致同类错误可能反复发生。这种机制缺失在急危重症场景中尤为危险,可能引发连锁反应,造成不可逆的临床后果。
2 医学AI在急危重症应用中问题的对策 2.1 数据问题解决办法 2.1.1 提升数据质量构建高质量的医疗信息系统是提升数据质量的基础。通过优化系统架构,增加AI辅助数据校验和纠错功能,从技术层面减少录入错误的发生率。同时加强对医护人员培训,提高其数据质量意识,规范数据录入流程,确保数据录入的准确性和规范性。建立全面的数据质量管理规范,涵盖数据采集、存储、传输、分析等各个环节,构建质量控制体系[20],定期对数据进行审查和监控,及时发现并纠正数据质量问题。运用AI和大数据分析技术,对数据进行自动清洗、去重和修复,提高数据的准确性和一致性。在技术层面,开发适用于急诊与ICU的智能数据修复工具,针对抢救过程中不可避免的数据缺失和异常,应用生理模型辅助数据修复与合理性验证。这种修复不仅依赖统计模型,更应融入急危重症病理生理学原理,确保数据修复符合危重症发展规律。
大语言模型能够通过自然语言处理技术提取非结构化数据中的关键信息,并将其转化为结构化特征,从而适应传统的机器学习模型。这种结合方式在实际应用中具有重要意义,在急诊场景中,医生的病例文书、影像学报告等非结构化数据占据了大部分医疗数据。通过大模型的处理,这些非结构化数据可以被转化为结构化的特征向量,进而输入到传统的机器学习模型中,用于病情评估和决策支持。
2.1.2 统一数据格式积极推广通用数据模型[21],以及其他医疗数据格式如HL7、ICD-10等,并结合我国国情制定适合国内医疗机构的国家级临床数据标准[20, 22]。强制推行统一的数据格式和编码规范,特别是关键生命体征指标、重症评分和预后数据的记录。针对分级诊疗体系中的不同层级医疗机构,制定差异化数据采集标准,基层医疗机构重点记录初始评估与转运指标,高级医疗中心则完成全流程精细化数据采集。
搭建健康信息交换平台或数据湖,采用开放标准和统一接口规范,打破“信息孤岛”,实现不同医疗机构间,同一医疗机构不同系统间的数据共享和流通。多模态AI与非结构化数据的融合,结合生成式AI技术,正在开启全新的应用场景与价值空间,为急危重症领域带来新的机遇。
2.1.3 应对数据异质性开展大规模的多中心、跨地区数据采集工作,广泛收集不同地域、医院和患者群体的数据,丰富数据的多样性,确保收集足够疾病亚类数据用于模型训练。在模型训练过程中的领域判别模型、对抗验证等技术,可以增强模型对不同数据特征的学习和适应能力,提高模型的泛化性能[23]。
建立大规模的临床数据库协作网络,鼓励各级医疗机构积极参与数据共享,整合分散在各个医疗机构和临床研究中的急危重症数据资源。构建覆盖全国的急危重症数据协作平台,实现院前急救、急诊抢救、ICU治疗到康复随访的全流程数据采集,确保数据在时间维度的连续性和临床表现的完整性。通过标准化的数据采集模板,记录患者基础信息、动态生命体征、实时检验检查结果、诊疗干预措施及预后随访等关键信息,为急危重症智能化救治提供丰富、高质量的训练数据基础。
建立动态知识更新机制,通过构建医学知识图谱的版本控制系统,持续跟踪诊断标准、治疗指南等关键医学概念的演变过程。系统自动监测权威医学期刊和指南更新,当检测到重要概念变更时(如脓毒症诊断标准从SIRS转向SOFA),触发模型参数的渐进式调整流程,确保AI系统与最新医学进展保持同步。此外构建应急学习通道,针对全新出现的疾病类型,建立特殊的数据采集和处理流程,允许模型在有限样本下进行快速适应。
由中国医药教育协会医共体急救工作委员会和中华急诊医学杂志社共同发起的,以浙江大学医学院附属邵逸夫医院为主体构建的DR.ECC数据库,是一个全流程、多模态急危重症数据库。DR.ECC数据库集成了从入急诊到康复随访的完整患者信息链,包括多维度个人基础信息、时序精确的体征数据、全过程诊疗操作记录、多模态结合的数据类型及预后随访,对如何建立急危重症数据库进行了初步实践探索。
2.2 技术挑战应对策略 2.2.1 加强模型基础建设加大对医疗机构算力设施的投入,建设高性能计算中心,配备先进的计算设备和存储系统[24],满足医学AI模型训练和运行的需求。建立稳定可靠的电力供应保障系统,确保算力设施的正常运行。加强急危重症AI交叉领域专业技术人才的培养和引进,通过高校医工交叉学科建设、急危重症专科AI培训等多种途径,培养同时具备危急医学处置能力和AI技术应用能力的复合型人才。同时,制定优惠政策,吸引优秀的技术人才投身医学AI领域,组建专业的技术团队,为医学AI模型的开发、维护和优化提供技术支持。
2.2.2 提高模型可解释性针对急危重症场景的特殊需求,未来可期待研发具有高时效性和可解释性的AI算法和模型,如基于临床路径的规则系统、快速决策树模型,以及具有潜力的思维链(chain of thought, CoT)技术。正如DeepSeekR1这类前沿AI模型有望通过思维链推理显著提升模型在复杂医疗决策中的透明度,使这些模型能够以直观易懂的方式在短时间内展示危急状态下的决策过程和依据。
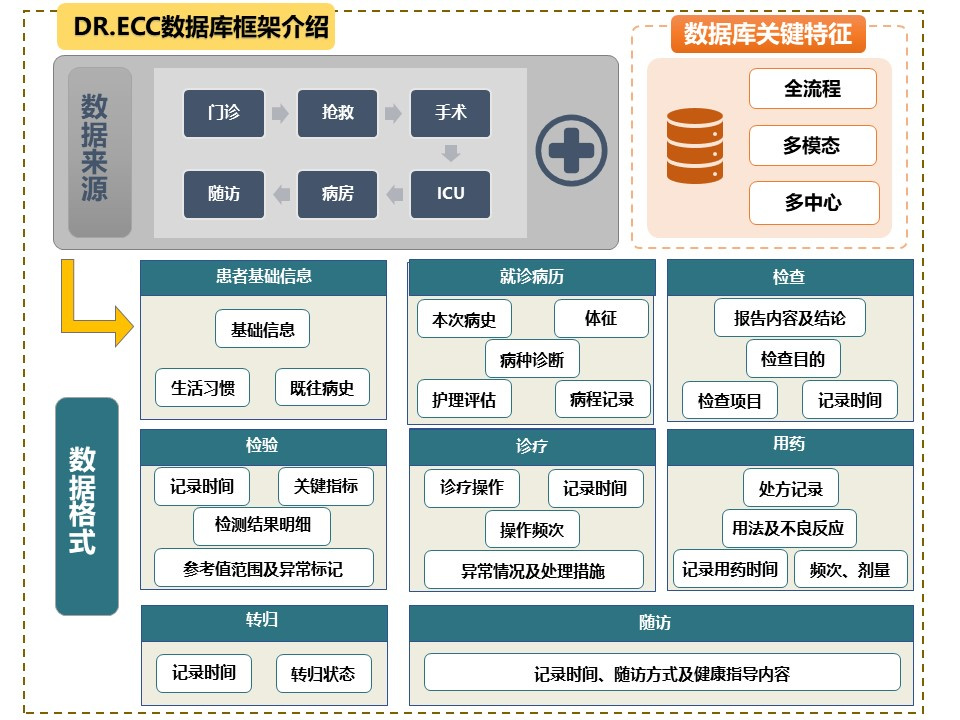
|
| 图 2 DR.ECC数据库框架 |
|
|
未来模型训练过程中,有望引入可解释性约束,使模型在保证准确性的同时,提高其可解释性[25-26]。此外,智能体(Agent)技术的潜在应用将可能使AI系统更自主地完成复杂的医疗决策链路,同时保持各环节的可追溯性。随着这些技术的发展与落地,医学AI有望从”黑箱”走向”透明”,增强医生对AI辅助决策的信任。
2.2.3 完善模型验证体系逐步建立完善模型验证体系的标准,制定针对急危重症特点的严格、科学的模型测试标准和流程,明确涵盖多种危急情境的测试内容、方法和指标。积极开展针对常见急危重症(如创伤休克、急性呼吸衰竭、心脏骤停等)的大规模、多中心随机对照临床试验,充分考虑不同级别医疗机构的急救环境差异、不同培训背景医生的操作习惯和区域患者群体特征差异等因素,全面评估模型在各种急救场景下的性能和可靠性。
在临床应用策略上,建议采用知识库与模型相结合的渐进式方案:在模型完成充分验证前,优先使用经过临床验证的知识库系统;待模型通过严格验证后,再逐步引入模型辅助决策,并建立相应的过渡评估机制。
2.2.4 增强应变能力建立全国性疾病数据实时监测网络,整合多层次医疗机构数据源,利用高级传感器、可穿戴设备和医疗物联网技术,构建覆盖从基层到大型医院的全景式数据采集体系,为疾病流行趋势分析提供多维数据支持。
针对多中心数据协作的挑战,引入基于联邦学习的技术架构,使各医疗机构能在保护数据隐私和遵守法规的前提下,共同训练和优化AI模型。联邦学习允许模型在不同机构间迭代更新,同时保持患者敏感数据留存在原机构内,有效解决了数据孤岛问题,并增强了模型的泛化能力。这种分布式学习框架特别适合于地域差异显著的医疗体系,能够兼顾区域特性和全局模式。
当发现疾病出现新的变化或出现新的疾病种类时,自动触发模型更新机制,运用增量学习、在线学习等技术,快速调整AI模型的参数和结构,使其能够及时适应疾病的变化,提高对急危重症疾病的诊断和预测能力[19]。
2.3 改善真实世界应用措施 2.3.1 提高模型的准确率高质量数据是构建准确AI模型的基础,建立严格的数据质量管理流程,包括数据采集标准化、多重交叉验证和定期质量审核,是提升模型准确率的前提条件。随着以大语言模型为代表的AI技术进步,模型准确率有望显著提升。这些模型在真实世界应用中展现出独特优势[27]:首先,其强大的缺失数据推理能力使其能在信息不完整的紧急情况下依然给出合理建议[28];其次,多模态融合能力允许模型同时处理结构化数据(如生命体征)和非结构化数据(如医嘱记录、护理记录),获取更全面的患者状态信息;第三,其持续学习框架使模型能够从真实世界的应用反馈中不断优化,逐步适应不同医疗环境。
2.3.2 加强AI重视程度开发系统的AI培训课程体系,包括AI基础理论、医学应用案例、实践操作技能等内容。利用线上线下相结合的培训方式,举办多样化的培训活动,邀请行业专家进行授课,提高医生对AI技术的理解和掌握程度。建立培训实践基地,为医生提供实际操作和模拟诊疗的机会,让医生在实践中熟悉AI辅助诊疗工具的使用方法,积累应用经验[29]。加强宣传及政策引导,通过医疗机构内部会议、行业研讨会、专业媒体报道等多种渠道,展示AI辅助急危重症诊疗的成功案例和实际效益,提高医疗从业者对AI技术价值的认同。
2.3.3 优化AI与临床的配合为解决模型与临床配合度低的问题,应采取全方位、系统性的应对策略[30]。首先,确立“临床问题驱动”的研发模式,将一线医生纳入AI模型全流程管理,从临床需求调研到实施评价全程参与,确保模型聚焦临床痛点。同时,组建多学科协作团队,整合临床医学、数据科学等领域专才,系统构建急危重症决策关键点地图,形成有序、全面的模型研发规划,优先解决综合性临床问题。
2.4 伦理问题解决途径 2.4.1 强化数据安全和隐私保护进一步细化《个人信息保护法》和《数据安全法》中针对医疗数据隐私保护的条款,制定专门的急危重症临床数据保护条例,明确医疗机构、数据使用者在紧急救治场景下的责任边界和义务。
加强对数据使用的监管,建立严格的数据访问权限管理机制和审计机制,记录和监控数据的使用情况,防止数据泄露和滥用[31]。定期对急诊科、ICU等相关医护人员进行数据安全意识培训,提高其在高压紧急情境下仍能保持数据安全防范意识和操作规范。
2.4.2 建立AI犯错应对机制建立健全AI犯错应对机制,特别是强化AI系统的错误检测与自我纠正能力,是保障医学AI健康发展的重要环节。在技术实现层面,建议采用精调(Fine-tuning)与检索增强生成相结合的方法,以增强模型对错误判断的识别能力并提升自我修正效能。同时需要构建包含人工审核的质量控制闭环系统,将临床实践中发现的错误案例系统性地反馈至工程团队,用于模型的持续优化。需要特别强调的是,所有AI系统应严格定位于临床辅助工具,其输出必须经过专业医务人员的审核与确认。
3 总结与展望医学AI在急危重症领域的应用为提高救治水平带来了新的希望,但目前面临的数据、技术、真实世界应用和伦理等方面的难题不容忽视。通过实施一系列针对性的对策,从提升数据质量、加强技术研发、改善临床应用和完善伦理规范等多方面入手,逐步攻克这些障碍,有望实现医学AI与急危重症临床诊疗的深度融合。本团队结合实际需求,提出了急危重症数据驱动的医疗模型训练一般流程(图 3),相信未来,随着技术的不断进步和研究的深入,持续关注并解决这些问题,将为提高急危重症患者的救治水平提供坚实有力的支持。
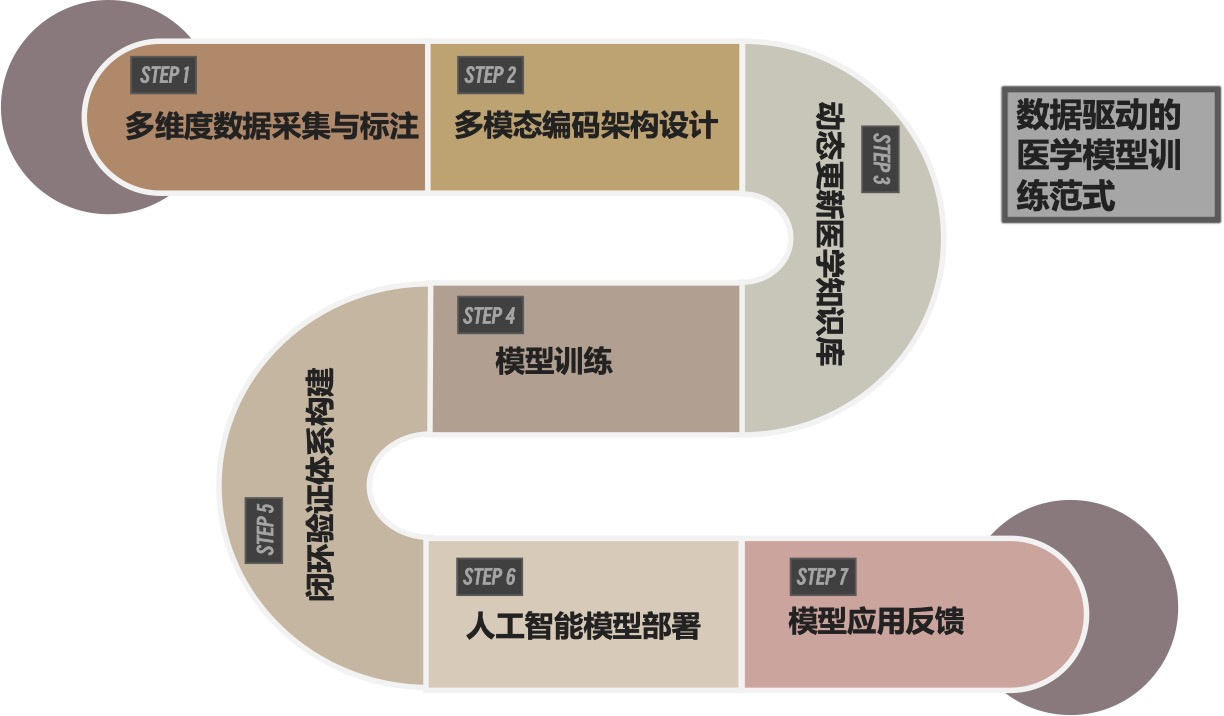
|
| 图 3 急危重症数据驱动的医疗模型训练范式 |
|
|
利益冲突 所有作者声明无利益冲突
| [1] | Ohbe H, Satoh K, Totoki T, et al. Definitions, epidemiology, and outcomes of persistent/chronic critical illness: a scoping review for translation to clinical practice[J]. Crit Care, 2024, 28(1): 435. DOI:10.1186/s13054-024-05215-4 |
| [2] | Kaul V, Enslin S, Gross SA. History of artificial intelligence in medicine[J]. Gastrointest Endosc, 2020, 92(4): 807-812. DOI:10.1016/j.gie.2020.06.040 |
| [3] | Eltaybani S. Capabilities and limitations of large language models in critical care nursing research: Examples from the big three[J]. Nurs Crit Care, 2023, 28(6): 838-853. DOI:10.1111/nicc.12974 |
| [4] | Sreedharan JK, Saleh F, Alqahtani A, et al. Applications of artificial intelligence in emergency and critical care diagnostics: a systematic review and meta-analysis[J]. Front Artif Intell, 2024, 7: 1422551. DOI:10.3389/frai.2024.1422551 |
| [5] | Yang J, Zhang B, Jiang XC, et al. Application of artificial intelligence to advance individualized diagnosis and treatment in emergency and critical care medicine[J]. Diagnostics (Basel), 2024, 14(7): 687. DOI:10.3390/diagnostics14070687 |
| [6] | Biesheuvel LA, Dongelmans DA, Elbers PWG. Artificial intelligence to advance acute and intensive care medicine[J]. Curr Opin Crit Care, 2024, 30(3): 246-250. DOI:10.1097/MCC.0000000000001150 |
| [7] | Kelly CJ, Karthikesalingam A, Suleyman M, et al. Key challenges for delivering clinical impact with artificial intelligence[J]. BMC Med, 2019, 17(1): 195. DOI:10.1186/s12916-019-1426-2 |
| [8] | Miller R, Whelan H, Chrubasik M, et al. A framework for current and new data quality dimensions: an overview[J]. Data, 2024, 9(12): 151. DOI:10.3390/data9120151 |
| [9] | Mitchell WG, Dee EC, Celi LA. Generalisability through local validation: overcoming barriers due to data disparity in healthcare[J]. BMC Ophthalmol, 2021, 21(1): 228. DOI:10.1186/s12886-021-01992-6 |
| [10] | Ghalavand H, Shirshahi S, Rahimi A, et al. Common data quality elements for health information systems: a systematic review[J]. BMC Med Inform Decis Mak, 2024, 24(1): 243. DOI:10.1186/s12911-024-02644-7 |
| [11] | 李丹彤, 梁会营, 刘广建. 临床科研数据库建设中的数据标准化问题探讨[J]. 中国数字医学, 2021, 16(1): 29-34. DOI:10.3969/j.issn.1673-7571.2021.01.006 |
| [12] | Rana SA, Azizul ZH, Awan AA. A step toward building a unified framework for managing AI bias[J]. PeerJ Comput Sci, 2023, 9: e1630. DOI:10.7717/peerj-cs.1630 |
| [13] | Lu C, Reddy CK, Wang D, et al. Multi-Label clinical time-series generation via Conditional GAN[J]. IEEE Xplore, 2024, 36(4): 1728-1740. DOI:10.1109/TKDE.2023.3310909 |
| [14] | 马晓春, 王亮. Sepsis 1.0到Sepsis 3.0的变迁与展望[J]. 医学研究生学报, 2017, 30(10): 1009-1012. DOI:10.16571/j.cnki.1008-8199.2017.10.001 |
| [15] | Chase JG, Preiser JC, Dickson JL, et al. Next-generation, personalised, model-based critical care medicine: a state-of-the art review of in silico virtual patient models, methods, and cohorts, and how to validation them[J]. Biomed Eng Online, 2018, 17(1): 24. DOI:10.1186/s12938-018-0455-y |
| [16] | Fleuren LM, Thoral P, Shillan D, et al. Machine learning in intensive care medicine: ready for take-off?[J]. Intensive Care Med, 2020, 46(7): 1486-1488. DOI:10.1007/s00134-020-06045-y |
| [17] | Taylor RA, Sangal RB, Smith ME, et al. Leveraging artificial intelligence to reduce diagnostic errors in emergency medicine: Challenges, opportunities, and future directions[J]. Acad Emerg Med, 2025, 32(3): 327-339. DOI:10.1111/acem.15066 |
| [18] | Zhang ZH, Chen L, Liu XL, et al. Exploring disease axes as an alternative to distinct clusters for characterizing sepsis heterogeneity[J]. Intensive Care Med, 2023, 49(11): 1349-1359. DOI:10.1007/s00134-023-07226-1 |
| [19] | Dziedzic A, Issa J, Chaurasia A, et al. Artificial intelligence and health-related data: the patient's best interest and data ownership dilemma[J]. Proc Inst Mech Eng H, 2024, 238(10): 1023-1028. DOI:10.1177/09544119241279630 |
| [20] | Et al S. Design of a clinical database to support research purposes: Challenges and solutions[J]. Int J Adv Appl Sci, 2021, 8(3): 21-29. DOI:10.21833/ijaas.2021.03.003 |
| [21] | von Gerich H, Chomutare T, Peltonen LM. Building bridges for federated learning in healthcare: review on approaches for common data model development[J]. Stud Health Technol Inform, 2024, 315: 711-712. DOI:10.3233/SHTI240292 |
| [22] | Wang Q, Ji ZC, Wang JQ, et al. A study of entity-linking methods for normalizing Chinese diagnosis and procedure terms to ICD codes[J]. J Biomed Inform, 2020, 105: 103418. DOI:10.1016/j.jbi.2020.103418 |
| [23] | Bellini V, Russo M, Domenichetti T, et al. Artificial intelligence in operating room management[J]. J Med Syst, 2024, 48(1): 19. DOI:10.1007/s10916-024-02038-2 |
| [24] | Ng MY, Helzer J, Pfeffer MA, et al. Development of secure infrastructure for advancing generative artificial intelligence research in healthcare at an academic medical center[J]. J Am Med Inform Assoc, 2025, 32(3): 586-588. DOI:10.1093/jamia/ocaf005 |
| [25] | Nagendran M, Festor P, Komorowski M, et al. Clinical evaluation framework using behavioural & visual attention read-outs for explainable AI (XAI)[EB/OL]. [2025-02-04]. https://papers.ssrn.com/abstract=4496127. |
| [26] | Lauritsen SM, Kristensen M, Olsen MV, et al. Explainable artificial intelligence model to predict acute critical illness from electronic health records[J]. Nat Commun, 2020, 11(1): 3852. DOI:10.1038/s41467-020-17431-x |
| [27] | Sarker IH. Machine learning: algorithms, real-world applications and research directions[J]. SN Comput Sci, 2021, 2(3): 160. DOI:10.1007/s42979-021-00592-x |
| [28] | Le LP, Nguyen T, Riegler MA, et al. Multimodal missing data in healthcare: a comprehensive review and future directions[J]. Comput Sci Rev, 2025, 56: 100720. DOI:10.1016/j.cosrev.2024.100720 |
| [29] | Baker Stein M, Jones-Schenk J. The future of nursing: navigating the AI revolution through education and training[J]. J Contin Educ Nurs, 2024, 55(3): 108-109. DOI:10.3928/00220124-20240221-03 |
| [30] | Mudgal SK, Agarwal R, Chaturvedi J, et al. Real-world application, challenges and implication of artificial intelligence in healthcare: an essay[J]. Pan Afr Med J, 2022, 43: 3. DOI:10.11604/pamj.2022.43.3.33384 |
| [31] | Mejía-Granda CM, Fernández-Alemán JL, Carrillo-de-Gea JM, et al. Security vulnerabilities in healthcare: an analysis of medical devices and software[J]. Med Biol Eng Comput, 2024, 62(1): 257-273. DOI:10.1007/s11517-023-02912-0 |
 2025, Vol. 34
2025, Vol. 34