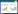2. 绍兴市人民医院急诊医学科,绍兴 312000;
3. 温岭市第一人民医院急诊医学科,温岭 317500;
4. 浙江省天台县人民医院急诊医学科,天台 317200;
5. 宁海县第一医院重症医学科,宁海 315600;
6. 嘉兴市中医医院急诊医学科,嘉兴 314001;
7. 台州市第一人民医院急诊医学科,台州 318020
2. Department of Emergency Medicine, Shaoxing People's Hospital, Shaoxing 312000, China;
3. Department of Emergency Medicine, the First People's Hospital of Wenling, Wenling 317500, China;
4. Department of Emergency Medicine, Tiantai County People's Hospital, Tiantai 317200, China;
5. Department of Intensive Care Medicine, the First Hospital of Ninghai, Ninghai 315600, China;
6. Department of Emergency Medicine, Jiaxing Hospital of Traditional Chinese Medicine, Jiaxing 314001, China;
7. Department of Emergency Medicine, Taizhou First People's Hospital, Taizhou 318020, China
心脏骤停(cardiac arrest, CA)是由心脏泵血功能突然丧失而危及生命的临床紧急状况[1]。心脏骤停后复苏导致全身缺血-再灌注损伤,继发多器官功能障碍,成为患者复苏后死亡与生活质量下降的主要原因[2-3]。研究表明,目标体温管理(targeted temperature management, TTM)是目前指南推荐用于改善CA患者结局的有效方法[4-6]。Kuboyama等[7]研究表明,TTM实施时机很重要,若在再灌注后15 min才开始实施的保护效应便可能消失。其他研究亦证明,复苏后越早实施TTM则保护效应越佳[8-9]。然而,临床上各种原因导致降温措施开始时间延迟、降温效率低,减弱了TTM的器官保护效应[10-11]。正如任礽和蔡菁[12]在对INTREPID研究分析中也指出,TTM的实际应用效果可能受到多种因素的影响,包括实施时机、降温效率以及需不断优化的TTM仪器设备。笔者团队成功研发了国产小型食道降温装置样机,开展在心脏骤停复苏后实施TTM效果的实验研究,现报道如下。
1 材料与方法 1.1 动物来源与分组国产健康雄性白猪30头,体质量(37±2) kg,购自上海甲干生物科技有限公司,动物合格证号为SCXK(沪)2020-0006。动物采用随机数字表法分为假手术(sham)组(S组,n=6)、正常温度(normothermia)组(NT组,n=8)、体表降温(surface cooling)组(SC组,n=8)与食道降温(esophageal cooling)组(EC组,n=8)。S组仅进行动物准备,其余3组经右心室电极释放交流电诱发CA 12 min+心肺复苏6 min的方法制备心脏骤停复苏模型。S组和NT组全程使用控温毯维持(37.5±0.5)℃。复苏成功后5 min,SC组和EC组分别应用体表降温毯和食道降温装置控制体温。本实验研究经浙江大学医学院附属第二医院动物伦理委员会审批备案(批准号2023-022)。
1.2 主要仪器与试剂主要仪器:BeneVision N15型多功能监护仪和SV350型呼吸机(深圳迈瑞公司),MCC-E型胸外按压仪(苏州尚领公司),R Series除颤监护仪(美国ZOLL公司),Emma呼气末二氧化碳监测仪(瑞典Masimo公司),压力监测导管(美国Edwards公司),Blanketrol Ⅲ型医用控温仪(美国CSZ公司),长直喉镜(美国Welch Allyn公司),连续心排血量监测仪(德国PULSION公司)。国产小型食道降温装置样机见图 1。

|
| 图 1 国产小型食道降温装置样机、导管实物与动物实验 Fig 1 The domestic small esophageal cooling device、physical catheter and animal experiment |
|
|
主要试剂:替来他明/唑拉西泮(法国Virbac公司),噻拉嗪(吉林华牧动物保健公司),丙泊酚(西安力邦制药公司),心肌肌钙蛋白(cardiac troponin Ⅰ, cTnI)、神经元特异性烯醇化酶(neuron specific enolase, NSE)、肌酐(creatinine, Cr)和肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, IFABP)ELISA检测试剂盒(上海美轩生物公司)。
1.3 动物准备经肌肉注射替来他明/唑拉西泮5 mg/kg和噻拉嗪1 mg/kg诱导麻醉,再经耳缘静脉注射丙泊酚2 mg/kg全身麻醉、经股静脉继以4 mg/(kg·h)泵入维持麻醉状态。经口气管插管,连接呼吸机,参数设置为容量控制模式、潮气量10 mL/kg、吸呼比1:2、氧体积分数21%,调节呼吸频率维持呼气末二氧化碳分压在35~40 mmHg。手术暴露右颈外静脉与左股动脉,置入中心静脉导管和PiCCO,连接多功能监护仪,用于定期检测每搏输出量(stroke volume, SV)、全心射血分数(global ejection fraction, GEF)、血管外肺水指数(extra-vascular lung water index, ELWI)和肺血管通透性指数(pulmonary vascular permeability index, PVPI)的变化。手术暴露右股动静脉,分别置入一根压力监测导管至胸主动脉与右心房位置,连续监测动脉血压、右心房压与核心体温,以及采集动静脉血标本。在诱颤前,拔出右颈外静脉内的中心静脉导管,置入室颤诱导电极至右心室位置,用于诱导室颤。经体表电极动态监测心电的变化,应用控温毯仪维持(37.5±0.5)℃正常体温。
1.4 模型制备与干预参照笔者团队之前的方法制作猪心脏骤停复苏模型[13]。首先经诱颤电极释放1 mA交流电诱发CA,确认成功后无干预观察12 min。参照指南标准实施心肺复苏流程,即机械胸外按压和机械通气,前者设置按压深度5 cm、频率100次/min,后者设置容量控制模式、潮气量7 mL/kg、呼吸频率10次/min、氧体积分数100%。于复苏2 min时,静脉注射肾上腺素20 μg/kg,后续每3 min重复1次。于复苏6 min时,经胸壁予以电除颤1次,能量为150 J双向波,迅速判断自主循环恢复情况。若未恢复,迅速实施复苏流程2 min后除颤1次,反复该流程直至自主循环恢复、或5次后宣布复苏失败。对于自主循环恢复的动物,连接呼吸机进行机械通气,参数同于动物准备阶段。SC组使用美国CSZ公司的Blanketrol Ⅲ型医用控温仪,加热/冷却功率为800 W,在降温阶段的循环水温设置为4℃;EC组使用国产小型食道降温装置样机,制冷功率为600 W,参照鼻胃管的留置方法,经口置入食道降温导管,深度约45 cm左右,降温阶段循环水温亦设置为4℃。将动物体温降至34℃,随之维持(34±0.5)℃的目标体温至复苏后6 h,再以0.5℃/ h复温至37℃。持续麻醉监护至复苏后12 h,再拔除所有血管内导管,停止机械通气、拔除气管插管后送回猪圈观察12 h。
1.5 观察指标造模前,记录体重、心率、平均动脉压、呼气末二氧化碳分压等生命体征,检测动脉血气分析。造模期间,记录复苏时间、复苏成功率、肾上腺素用量、除颤次数等复苏结局情况。于造模前与复苏后12 h内,持续监测核心体温的变化。于造模前与复苏后1 h、2 h、4 h、6 h、9 h、12 h时,检测心功能指标SV和GEF、肺水肿指标ELWI和PVPI的变化。于造模前与复苏后2 h、6 h、12 h和24 h时,经股静脉采集血液标本2 mL,离心获取上清液,置于-80℃深低温冰箱保存,择期应用ELISA法检测cTnI、NSE、Cr、IFABP等指标。于复苏后24 h时,应用神经功能缺损评分(neurological deficit score, NDS)[14-15]和脑功能表现分级(cerebral performance category, CPC)[16]评估神经功能状态。于复苏后24 h时,对动物实施安乐死,迅速获取食道降温组的食道上段、中段、下段黏膜组织,进行固定、包埋、切片等处理,择期进行苏木精伊红染色,再在显微镜下拍照观察,评估食道黏膜的损伤情况。
1.6 统计学方法应用SPSS 20.0统计软件(美国IBM公司)进行数据统计学分析。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析。计数资料以百分率表示,组间比较采用精确检验法。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组动物的基础参数和复苏情况四组动物基础状态下的体重、核心体温、血流动力学参数、动脉血pH值和乳酸等均在正常水平,组间比较差异均无统计学意义(均P > 0.05),见表 1。经历心脏骤停复苏过程的三组动物均成功复苏6头,各组的复苏成功率、复苏时间、除颤次数、肾上腺素用量等指标,组间比较差异均无统计学意义(均P > 0.05)。
| 组别 | n | 体重(kg) | 心率(次/min) | 平均动脉压(mmHg) | 呼气末二氧化碳分压(mmHg) | 动脉血pH值 | 乳酸(mmol/L) | 核心体温(℃) |
| S组 | 6 | 36.8±1.9 | 78±6 | 93±8 | 37.0±2.3 | 7.44±0.04 | 0.83±0.33 | 37.6±0.2 |
| NT组 | 8 | 36.1±1.7 | 79±6 | 97±7 | 37.0±1.9 | 7.47±0.02 | 1.13±0.57 | 37.3±0.4 |
| SC组 | 8 | 37.8±1.4 | 80±4 | 94±5 | 37.0±1.4 | 7.47±0.06 | 1.02±0.45 | 37.4±0.3 |
| EC组 | 8 | 37.3±1.8 | 81±4 | 95±4 | 38.0±1.2 | 7.44±0.04 | 1.09±0.57 | 37.5±0.3 |
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温 | ||||||||
TTM降温阶段,EC组与SC组核心体温均迅速下降,但EC组较SC组温度下降更为快速,且在复苏后45 min开始两组间差异均有统计学意义(均P < 0.05)。EC组降温速率和达标时长均显著优于SC组,分别为(1.52±0.18)℃/h vs.(0.94±0.32)℃/ h、(2.32±0.43)h vs.(3.78±0.82)h(均P < 0.05)。低温维持阶段,EC组与SC组核心体温均维持在一致的目标水平,组间比较差异均无统计学意义(均P > 0.05);复温阶段EC组与SC组核心体温保持一致的上升趋势,组间比较差异均无统计学意义(均P > 0.05),见图 2。
|
| 注:S,假手术;NT,正常体温;SC,体表降温;EC,食道降温;BL,基线值。与S组比较,aP < 0.05;与NT组比较,bP < 0.05;与SC组比较,cP < 0.05 图 2 各组动物核心体温的变化 Fig 2 The changes of core temperature in each group |
|
|
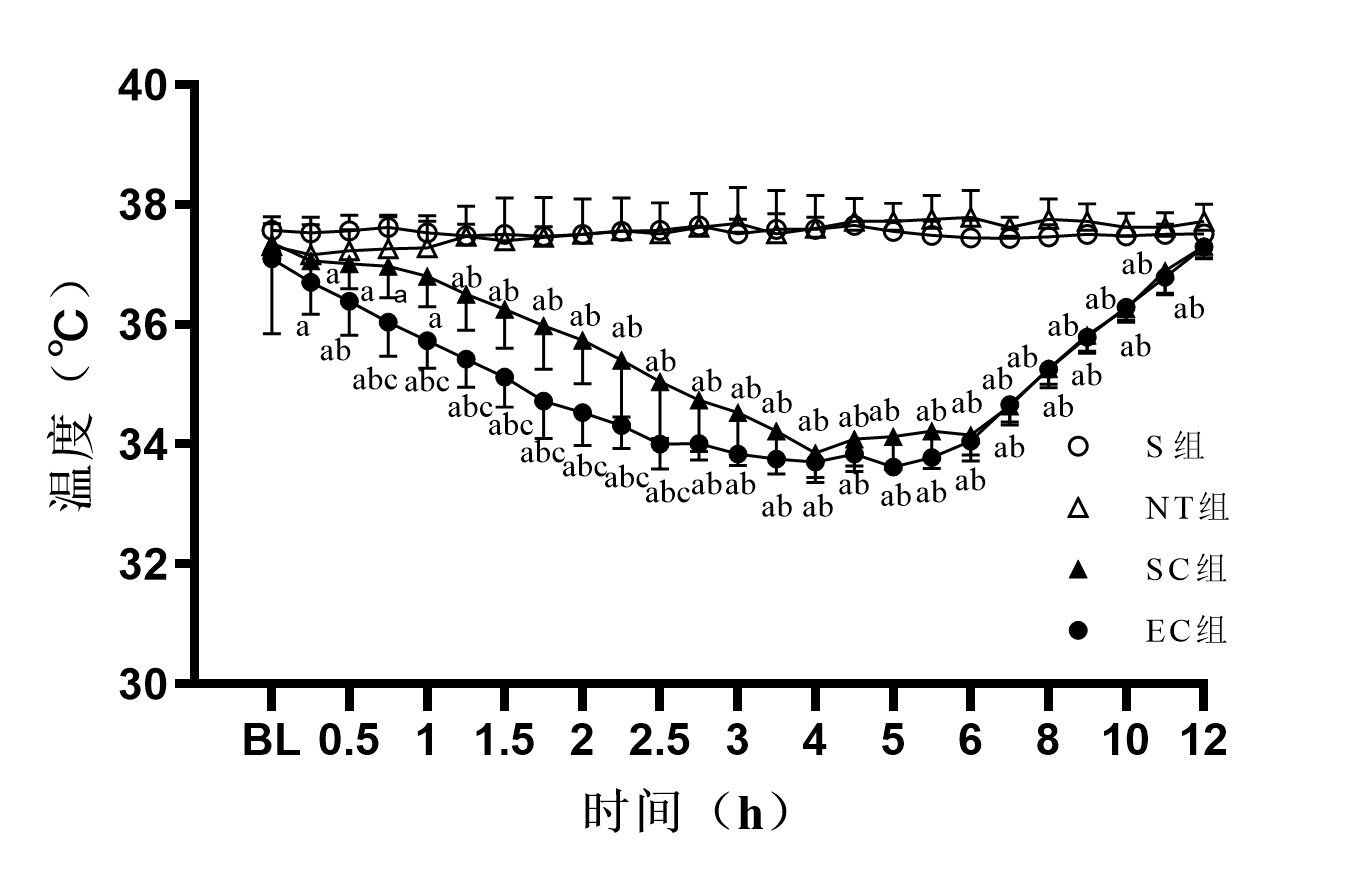
与S组相比,其他三组均出现复苏后心率增快, 其中NT组在复苏后1 h、2 h、4 h与9 h时,SC组在复苏后1 h、2 h与9 h时,EC组在复苏后1h与2h时,心率均显著增快,组间比较差异有统计学意义(均P < 0.05)。此外,NT组、SC组和EC组在复苏后各时间点的心率,组间比较差异无统计学意义(均P > 0.05)。与S组相比,NT组在复苏后2 h、4 h、6 h与9 h时血压显著下降,组间比较差异有统计学意义(均P < 0.05);与S组相比,SC组和EC组在复苏后各时间点的血压,组间比较差异无统计学意义(均P > 0.05)。此外,NT组、SC组和EC组在复苏后各时间点的血压,组间比较差异无统计学意义(均P > 0.05)。见图 3。
|
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温;BL,基线值。与S组比较,aP < 0.05 图 3 各组动物血流动力学参数的变化 Fig 3 The changes of hemodynamics in each group |
|
|
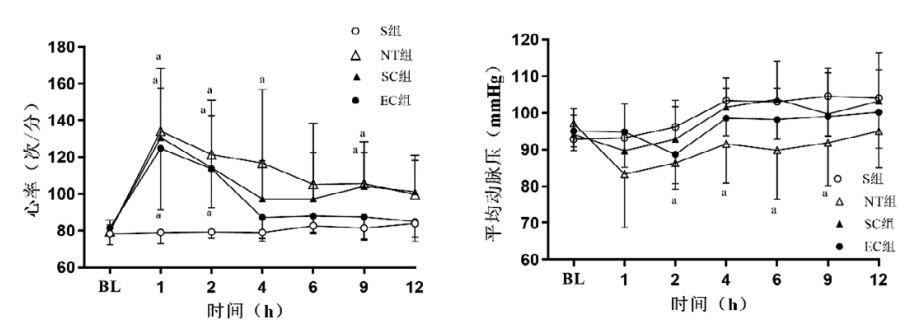
与S组相比,其他三组均出现复苏后心肌损伤及功能障碍,表现为SV与GEF值显著降低、cTnI血清浓度显著升高,组间比较差异均有统计学意义(均P < 0.05)。与NT组相比,SC组SV在复苏后1 h时和EC组SV在复苏后1 h、9 h、12 h时显著升高,以及SC组和EC组GEF在复苏后1 h、2 h、4 h、6 h时显著上升、cTnI在复苏6 h后显著下降,组间比较差异均有统计学意义(均P < 0.05)。与SC组相比,EC组心肌损伤及功能障碍指标进一步改善,且cTnI在复苏2 h后显著下降,组间比较差异均有统计学意义(均P < 0.05)。见图 4。
|
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温;SV,每搏输出量;GEF,全心射血分数;cTnI,心肌肌钙蛋白I;BL,基线值。与S组比较,aP < 0.05;与NT组比较,bP < 0.05;与SC组比较,cP < 0.05 图 4 各组动物心脏功能与损伤指标的变化 Fig 4 The changes of cardiac function and markers of myocardial injury in each group |
|
|
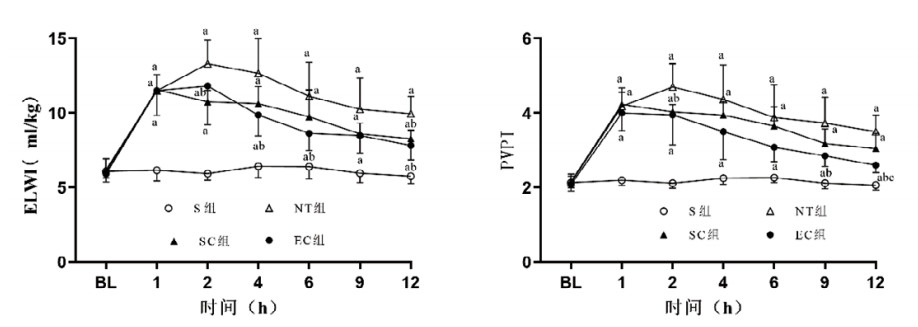
与S组相比,其他三组均出现复苏后肺损伤,表现为ELWI与PVPI值显著升高,组间比较差异均有统计学意义(均P < 0.05)。与NT组相比,SC组ELWI在复苏后2 h和12 h时、PVPI在复苏后2 h时显著降低,EC组ELWI在复苏后4 h、6 h和12 h时、PVPI在复苏后9 h和12 h时显著下降,组间比较差异均有统计学意义(均P < 0.05)。与SC组相比,EC组肺损伤指标进一步改善,且PVPI在复苏后12 h时显著下降,组间比较差异有统计学意义(P < 0.05)。见图 5。
|
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温;ELWI,血管外肺水指数;PVPI,肺血管通透性指数;BL,基线值。与S组比较,aP < 0.05;与NT组比较,bP < 0.05;与SC组比较,cP < 0.05 图 5 各组动物肺损伤指标的变化 Fig 5 The changes of lung injury indicators in each group |
|
|
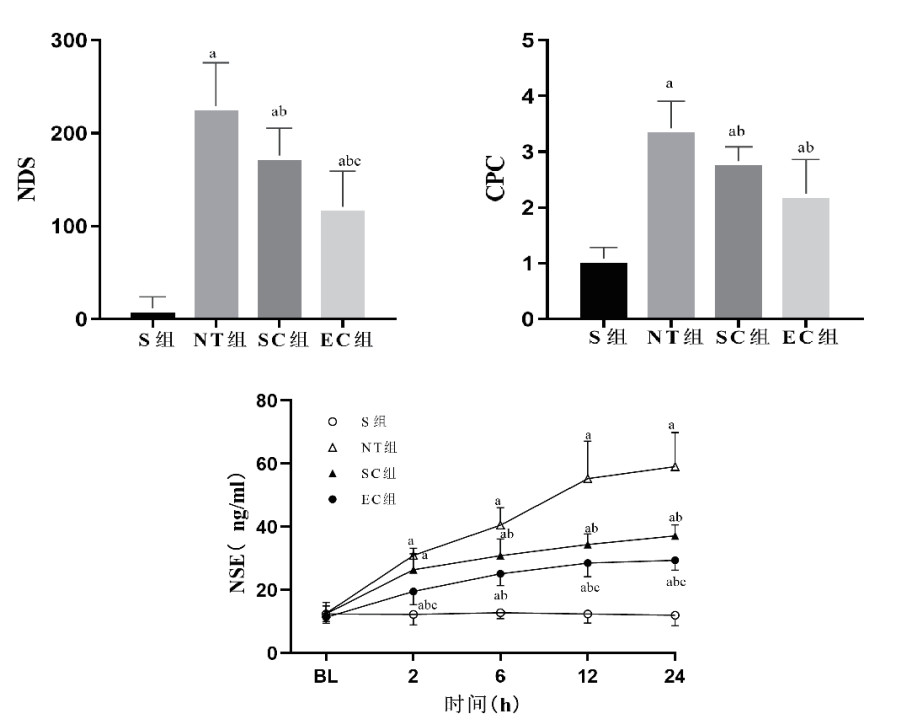
与S组相比,其他三组均出现复苏后脑损伤及神经功能障碍,表现为NDS和CPC评分显著升高、NSE血清浓度显著上升,组间比较差异均有统计学意义(均P < 0.05)。与NT组相比,SC组和EC组在复苏后24 h时NDS和CPC评分均显著降低,以及SC组在复苏6h后和EC组在复苏2 h后NSE的血清浓度显著下降,组间比较差异均有统计学意义(均P < 0.05)。与SC组相比,EC组在复苏后24 h时NDS评分显著降低,以及在复苏后2 h、12 h和24 h时NSE的血清浓度均显著下降,组间比较差异均有统计学意义(均P < 0.05)。见图 6。
|
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温;NDS,神经功能缺损评分;CPC,脑功能表现分级;NSE,神经元特异性烯醇化酶;BL,基线值。与S组比较,aP < 0.05;与NT组比较,bP < 0.05;与SC组比较,cP < 0.05 图 6 各组动物脑功能评分和损伤指标的变化 Fig 6 The changes of brain function score and markers of cerebral injury in each group |
|
|
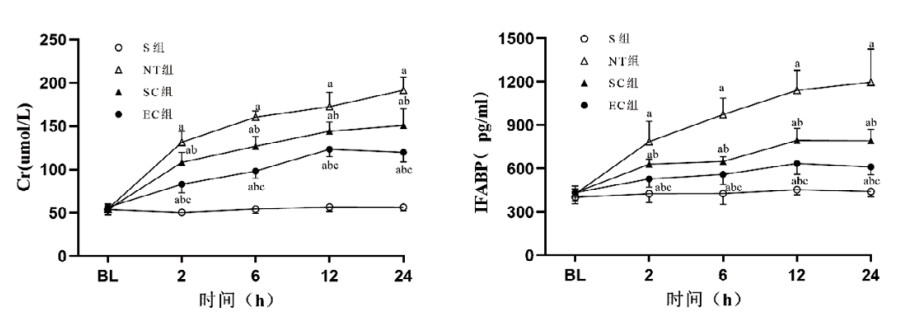
与S组相比,其他三组均出现复苏后肾、肠损伤,表现为Cr和IFABP血清浓度显著上升,组间比较差异均有统计学意义(均P < 0.05)。与NT组相比,SC组和EC组复苏2 h后Cr和IFABP的血清浓度显著降低,组间比较差异均有统计学意义(均P < 0.05)。与SC组相比,EC组在复苏2 h后Cr和IFABP的血清浓度进一步显著降低,组间比较差异均有统计学意义(均P < 0.05)。见图 7。
|
| 注:S,假手术;NT,正常温度;SC,体表降温;EC,食道降温;Cr,肌酐;IFABP,肠型脂肪酸结合蛋白;BL,基线值。与S组比较,aP < 0.05;与NT组比较,bP < 0.05;与SC组比较,cP < 0.05 图 7 各组动物肾、肠损伤标志物的变化 Fig 7 The changes of markers of kidney and intestinal injury in each group |
|
|
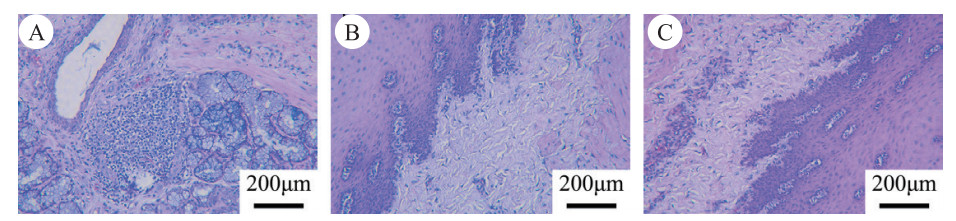
在复苏后24 h时,获取EC组的食道上段、中段、下段黏膜组织,进行病理分析的结果显示,EC组的食道上段、中段、下段黏膜组织未见明显细胞坏死、未见明显炎性细胞浸润、未见明显异常。见图 8。
|
| 注:上段(A)、中段(B)、下段(C)黏膜的HE染色,显示黏膜组织的病理表现均未见明显细胞坏死、未见明显炎性细胞浸润 图 8 食道降温组动物的食道病理图像 Fig 8 Esophageal pathological images of animals in the EC group |
|
|
当前国际心肺复苏指南[4, 17]推荐TTM是心脏骤停后综合征治疗的重要措施。有多项研究表明,TTM虽能改善CA患者复苏后神经系统为主的多器官功能障碍,但其实施的效果与启动时机、目标温度设置及达标时长、温度维持稳定性、复温速率和发热控制等因素有关。其中早期快速降温是产生保护效应的关键因素[18-23]。传统的降温方法主要包括冰盐水、冰袋、冰帽、冰毯、电风扇等等,虽成本低、易于获得,但降温效能较低且温度波动大,还存在导致寒颤、皮肤损伤与感染的风险[24-26]。针对上述问题,开发适于CA患者早期快速实施TTM、且安全便携的新型温控技术装备,显得非常必要。
2012年,Vaicys等[27]首先利用数学模型探讨经食道诱导实施TTM的可行性,结果发现经食道能从心脏、肺脏、主动脉与腔静脉等大血流器官摄取机体热能,从而达到快速降温的目的[28]。随后Kulstad等[29]开发了一种直径12 mm的经食道降温导管,结果显示其灌注冰盐水后降低65 kg猪体温的速率为1.3℃/h。此外,Schroeder等[30]研制了另一种设计理念、直径分别为11 mm和14.7 mm的经食道降温导管,结果发现二者对27.2 kg猪降低体温的速率分别为2.8℃/h与3.0℃/h。笔者团队前期试制了一种热传导性佳、热交换面积大的螺旋式食道降温导管,并利用猪心肺复苏模型发现该导管对36.7 kg猪降低体温的速率为2.8℃/h,降温效率接近于传统体表降温法的2倍[31]。由此可见,经食道实施TTM是一种可靠的快速降温技术,但目前国内缺乏相应的设备和导管,且传统降温毯的主机较大而不适合在院前环境中使用,因此有必要开发一款小型便携的经食道降温装置。
笔者团队利用热电制冷机模型,整合制冷片、冷却水泵、散热水泵和散热风扇等部件形成小型化温控主机,通过精准控制主机内的液体温度并将其循环注入食道降温导管后与机体发生热量交换,从而达到降低温度的目的。首先,团队选择了与人类在解剖结构、生理参数相近的猪作为实验对象,开展国产小型食道降温装置的应用效果探索。其次,结合临床上心脏骤停后综合征的损伤特点,选择应用较长时程的12 min心脏骤停+6 min心肺复苏的建模参数。本研究结果显示,国产小型食道降温装置的降温速率为1.52℃/h、明显快于传统体表降温法的0.94℃/h,达到目标温度的时长为2.32 h、显著短于体表降温法的3.78 h;在低温维持与复温效果上两种方法一致,提示该食道降温装置在早期快速实施TTM方面优于传统的体表降温方法。分析两种降温装置的性能指标,国产小型食道降温装置与进口医用控温仪的功率分别为600 W、800 W,每分钟循环水量分别为3.5 L/min、2.27 L/min,前者占据毗邻心肺与大血管的整个食道、后者包裹整个躯干,故二者在设置同等4℃的循环水温时,国产小型食道降温装置因其留置部位与冷水流量而产生更佳的降温效果。
心脏骤停复苏会导致多器官损伤,实施TTM的主要目的是改善器官功能障碍,故本研究观察了不同降温技术对复苏后多器官损伤作用的效果。结果显示,与NT组相比,SC组和EC组SV在复苏后1 h时、GEF在复苏后1 h、2 h、4 h、6 h时均显著升高,ELWI在复苏12 h时显著下降,cTnI和NSE在复苏6 h后、Cr和IFABP在复苏2 h后均显著降低,NDS和CPC在复苏后24 h时均显著减少,提示两种低温方法均能减轻复苏后多器官损伤。但与SC组相比,EC组PVPI在复苏后12 h时显著下降,cTnI、Cr和IFABP在复苏2 h后均显著降低,NSE在复苏后2 h、12 h、24 h时均显著降低,NDS在复苏后24 h时显著减少,提示食道降温装置较传统体表降温方法具有更好的复苏后多器官保护作用。进一步分析食道降温装置使用的潜在不良反应,可能会出现置管过程中的口腔、咽喉与食道的机械性损伤,以及低温实施过程中的食道黏膜损伤。本研究结果显示,食道降温组未观察到上述不良反应的出现,与笔者前期的研究结果一致[31]。因此,经食道降温装置实施TTM是安全的。
本研究有一些局限性。首先,研究设置的TTM实施时长为12 h,未观察更长时间至24 h或以上。其次,本研究只评估了复苏后多器官功能及损伤标志物的情况,未进行器官组织的病理损伤程度检测。第三,由于是动物实验,无法评估吞咽困难及吞咽疼痛程度等可能反映上消化道功能影响的指标。第四,当前食道降温装置的主机体积大小为460 mm×260 mm×260 mm,重量约8.9 kg,功率600 W左右,有待继续优化体积、重量与功率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 马海英、毛祎、梅之瀚、陈启江、徐帅、罗宇杰、徐杰丰:实验操作;马海英、徐杰丰:论文撰写、数据收集及整理、统计学分析;张茂:研究设计、论文修改
| [1] | Tsao CW, Aday AW, Almarzooq ZI, et al. Heart disease and stroke statistics-2022 update: a report from the American heart association[J]. Circulation, 2022, 145(8): e153-e639. DOI:10.1161/CIR.0000000000001052 |
| [2] | Sandroni C, Cronberg T, Sekhon M. Brain injury after cardiac arrest: pathophysiology, treatment, and prognosis[J]. Intensive Care Med, 2021, 47(12): 1393-1414. DOI:10.1007/s00134-021-06548-2 |
| [3] | Yao Y, Johnson NJ, Perman SM, et al. Myocardial dysfunction after out-of-hospital cardiac arrest: predictors and prognostic implications[J]. Intern Emerg Med, 2018, 13(5): 765-772. DOI:10.1007/s11739-017-1756-z |
| [4] | Panchal AR, Bartos JA, Cabañas JG, et al. Part 3: adult basic and advanced life support: 2020 American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S366-S468. DOI:10.1161/CIR.0000000000000916 |
| [5] | Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia[J]. N Engl J Med, 2002, 346(8): 557-563. DOI:10.1056/NEJMoa003289 |
| [6] | Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest[J]. N Engl J Med, 2002, 346(8): 549-556. DOI:10.1056/NEJMoa012689 |
| [7] | Kuboyama K, Safar P, Radovsky A, et al. Delay in cooling negates the beneficial effect of mild resuscitative cerebral hypothermia after cardiac arrest in dogs: a prospective, randomized study[J]. Crit Care Med, 1993, 21(9): 1348-1358. DOI:10.1097/00003246-199309000-00019 |
| [8] | Abella BS, Zhao DH, Alvarado J, et al. Intra-arrest cooling improves outcomes in a murine cardiac arrest model[J]. Circulation, 2004, 109(22): 2786-2791. DOI:10.1161/01.CIR.0000131940.19833.85 |
| [9] | Scolletta S, Taccone FS, Nordberg P, et al. Intra-arrest hypothermia during cardiac arrest: a systematic review[J]. Crit Care, 2012, 16(2): R41. DOI:10.1186/cc11235 |
| [10] | Awad A, Dillenbeck E, Dankiewicz J, et al. Transnasal evaporative cooling in out-of-hospital cardiac arrest patients to initiate hypothermia-a substudy of the target temperature management 2 (TTM2) randomized trial[J]. J Clin Med, 2023, 12(23): 7288. DOI:10.3390/jcm12237288 |
| [11] | Dankiewicz J, Cronberg T, Lilja G, et al. Hypothermia versus normothermia after out-of-hospital cardiac arrest[J]. N Engl J Med, 2021, 384(24): 2283-2294. DOI:10.1056/NEJMoa2100591 |
| [12] | 任礽, 蔡菁. 从INTREPID再谈重症脑血管疾病的目标体温管理: 问题与挑战依旧[J]. 中华急诊医学杂志, 2024, 33(12): 1655-1658. DOI:10.3760/cma.j.issn.1671-0282.2024.12.001 |
| [13] | Xu JF, Zhao X, Jiang XK, et al. Tubastatin A improves post-resuscitation myocardial dysfunction by inhibiting NLRP3-mediated pyroptosis through enhancing transcription factor EB signaling[J]. J Am Heart Assoc, 2022, 11(7): e024205. DOI:10.1161/JAHA.121.024205 |
| [14] | Jia XF, Koenig MA, Nickl R, et al. Early electrophysiologic markers predict functional outcome associated with temperature manipulation after cardiac arrest in rats[J]. Crit Care Med, 2008, 36(6): 1909-1916. DOI:10.1097/CCM.0b013e3181760eb5 |
| [15] | Jia XF, Koenig MA, Shin HC, et al. Improving neurological outcomes post-cardiac arrest in a rat model: immediate hypothermia and quantitative EEG monitoring[J]. Resuscitation, 2008, 76(3): 431-442. DOI:10.1016/j.resuscitation.2007.08.014 |
| [16] | Jakkula P, Hästbacka J, Reinikainen M, et al. Near-infrared spectroscopy after out-of-hospital cardiac arrest[J]. Crit Care, 2019, 23(1): 171. DOI:10.1186/s13054-019-2428-3 |
| [17] | Nolan JP, Sandroni C, Böttiger BW, et al. European resuscitation council and European society of intensive care medicine guidelines 2021: post-resuscitation care[J]. Intensive Care Med, 2021, 47(4): 369-421. DOI:10.1007/s00134-021-06368-4 |
| [18] | Lascarrou JB, Merdji H, Le Gouge A, et al. Targeted temperature management for cardiac arrest with nonshockable rhythm[J]. N Engl J Med, 2019, 381(24): 2327-2337. DOI:10.1056/NEJMoa1906661 |
| [19] | Arrich J, Schütz N, Oppenauer J, et al. Hypothermia for neuroprotection in adults after cardiac arrest[J]. Cochrane Database Syst Rev, 2023, 5(5): CD004128. DOI:10.1002/14651858.CD004128.pub5 |
| [20] | Taccone FS, Picetti E, Vincent JL. High quality targeted temperature management (TTM) after cardiac arrest[J]. Crit Care, 2020, 24(1): 6. DOI:10.1186/s13054-019-2721-1 |
| [21] | Schock RB, Janata A, Frank Peacock W, et al. Time to cooling is associated with resuscitation outcomes[J]. Ther Hypothermia Temp Manag, 2016, 6(4): 208-217. DOI:10.1089/ther.2016.0026 |
| [22] | Stanger D, Kawano T, Malhi N, et al. Door-to-targeted temperature management initiation time and outcomes in out-of-hospital cardiac arrest: insights from the continuous chest compressions trial[J]. J Am Heart Assoc, 2019, 8(9): e012001. DOI:10.1161/JAHA.119.012001 |
| [23] | Awad A, Taccone FS, Jonsson M, et al. Time to intra-arrest therapeutic hypothermia in out-of-hospital cardiac arrest patients and its association with neurologic outcome: a propensity matched sub-analysis of the PRINCESS trial[J]. Intensive Care Med, 2020, 46(7): 1361-1370. DOI:10.1007/s00134-020-06024-3 |
| [24] | Rosman J, Hentzien M, Dramé M, et al. A comparison between intravascular and traditional cooling for inducing and maintaining temperature control in patients following cardiac arrest[J]. Anaesth Crit Care Pain Med, 2018, 37(2): 129-134. DOI:10.1016/j.accpm.2016.08.009 |
| [25] | Tommasi E, Lazzeri C, Bernardo P, et al. Cooling techniques in mild hypothermia after cardiac arrest[J]. J Cardiovasc Med (Hagerstown), 2017, 18(7): 459-466. DOI:10.2459/JCM.0000000000000130 |
| [26] | Rohit RK, Tibrewal C, Modi NS, et al. Effectiveness of induced hypothermia on the prognosis of post-cardiac arrest patients: a scoping literature review[J]. Cureus, 2023, 15(8): e43064. DOI:10.7759/cureus.43064 |
| [27] | Vaicys V, Eason A, Schieber JD, et al. Therapeutic hypothermia induction via an esophageal route: a computer simulation[J]. Am J Emerg Med, 2012, 30(6): 932-935. DOI:10.1016/j.ajem.2011.04.026 |
| [28] | Kulstad EB, Mark Courtney D, Waller D. Induction of therapeutic hypothermia via the esophagus: a proof of concept study[J]. World J Emerg Med, 2012, 3(2): 118-122. DOI:10.5847/wjem.j.issn.1920-8642.2012.02.007 |
| [29] | Kulstad E, Metzger AK, Mark Courtney D, et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device[J]. Resuscitation, 2013, 84(11): 1619-1624. DOI:10.1016/j.resuscitation.2013.06.019 |
| [30] | Schroeder DC, Guschlbauer M, Maul AC, et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management[J]. PLoS One, 2017, 12(3): e0173229. DOI:10.1371/journal.pone.0173229 |
| [31] | Xu JF, Jin XH, Chen QJ, et al. Faster hypothermia induced by esophageal cooling improves early markers of cardiac and neurological injury after cardiac arrest in swine[J]. J Am Heart Assoc, 2018, 7(21): e010283. DOI:10.1161/JAHA.118.010283 |
 2025, Vol. 34
2025, Vol. 34