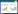2. 中山大学附属第三医院急诊科,广州 510630;
3. 国家老年疾病临床医学研究中心(湘雅医院),长沙 410008
脓毒症3.0的定义指出其是由宿主对感染反应失调引起的一种危及生命的器官功能障碍[1-2]。脓毒症是危重病患者的常见病因或并发症, 也是引起多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)的常见危险因素,更是患者的主要死亡原因之一[3-5]。脓毒症因发展迅速、病情凶险、病死率较高,每年都给各个国家带来沉重的负担[6-9],相当部分脓毒症患者甚至后续可能出现不良心血管事件、卒中、晚期死亡等长期并发症[10-11]。当前认为脓毒症的病理机制主要包括持续的过度炎症反应、免疫抑制和稳态失衡[12-14]。尽管对脓毒症的认识逐渐加深,脓毒症患者的存活率也在慢慢改善,但是目前尚未研发出特效药。
高迁移率族蛋白B1(high mobility group protein B1, HMGB1)通常与DNA结合,存在于包括免疫细胞、内皮细胞和上皮细胞等几乎所有细胞的细胞核中。HMGB1不仅仅是一种核蛋白,起到调控转录、复制、DNA损伤修复、维持核小体稳定等作用;还是一种细胞因子,能被释放到细胞外,在炎症、创伤、脓毒症等多种疾病中参与免疫调节等病理生理机制[15-18]。HMGB1是脓毒症中重要的晚期炎症介质[19],是脓毒症的潜在治疗靶点。整合素是一类大的跨膜黏附受体家族,其结构是由α、β两个亚基通过非共价键结合的方式组成异源二聚体。目前发现整合素家族存在18种α亚基以及8种β亚基,组成24种不同的整合素,其生理功能多样,在机体的免疫反应、组织和器官的发育、细胞的迁移和存亡等方面发挥着重要的作用[20-22]。西仑吉肽是整合素αvβ3和αvβ5拮抗剂,已经多次应用于肿瘤治疗的临床研究。研究中发现,整合素αvβ3在脓毒症中的表达广泛升高[23-24],整合素αvβ3和αvβ5参与了脓毒症中巨噬细胞的胞葬作用[25]。既往研究表明,体外予以西仑吉肽可以阻止细菌通过整合素αvβ3黏附于内皮细胞,改善内皮功能[26-27]。也有研究证实,拮抗整合素CD11b可以抑制HMGB1的核质易位和释放,从而改善脓毒症小鼠的存活率[28]。因此,本研究以LPS和ATP共同诱导小鼠巨噬细胞RAW264.7建立体外炎症模型,观察西仑吉肽对细胞炎症反应中的HMGB1的调控作用。
1 材料与方法 1.1 细胞小鼠巨噬细胞RAW264.7由中南大学湘雅医院骨科实验室所赠。
1.2 实验试剂DMEM培养基购自美国Hyclone公司;胎牛血清(FBS)购自美国Thermo公司;胰蛋白酶购自以色列Biological Industries公司;脂多糖(LPS)购自美国Sigma公司;西仑吉肽(Cilengitide,批号:65520)购自上海MedChemExpress公司;三磷酸腺苷(ATP)、Western细胞裂解液、BCA蛋白定量检测试剂盒、一抗稀释液、蛋白酶抑制剂cocktail购自江苏碧云天生物有限公司;Tubulin内参抗体、HMGB1抗体、兔二抗购自有英国Abcam公司;ECL化学发光液购自美国Roche公司;TRNzol Universal总RNA提取试剂、mRNA逆转录试剂盒购自北京天根生化科技有限公司;qPCR试剂盒购自广州易锦生物技术有限公司;IL-1β ELISA试剂盒、IL-6 ELISA试剂盒、TNF-α ELISA试剂盒购自武汉华美生物工程有限公司。
1.3 实验仪器DM4000光学显微镜,Leica公司(德国);高性能无菌实验台,苏净安泰公司;CO2细胞培养箱,Thermo FORMA公司(美国);ParadigmTM Detection Platform酶标仪,Beckman-Coulter公司(美国);小型电泳仪和转膜设备,Bio-Rad公司(美国);FluroChemTM FC3成像分析仪,Protein Simple公司(美国);双人单面净化工作台,苏州金净净化设备科技有限公司。
1.4 细胞培养和实验分组巨噬细胞用含10%FBS的DMEM培养基置于37℃、5% CO2细胞培养箱培养,2 d换液或传代。取处于对数生长期的细胞进行分组实验:以106/mL细胞悬浮液铺板于6孔板,置于培养箱中培养12 h后保证细胞贴壁,然后分组予以刺激:①空白对照组:细胞一直予以培养基培养,当炎症模型组开始处理时进行更换新的培养基;②炎症模型组:予以终浓度1 μg/mL的LPS溶液刺激细胞12 h,再加入终浓度5 mmol/l的ATP刺激0.5 h;③西仑吉肽干预组:预先予以终浓度1 μmol/L的西仑吉肽溶液处理细胞24 h,再对细胞同时予以和炎症模型组相同的处理。
1.5 RT-qPCR检测HMGB1的mRNA表达水平按2.1方法处理细胞后,各组采用Trizol方法分别提取总RNA,测定各样本RNA浓度后,逆转录制备cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,进行荧光实时定量PCR扩增,检测各组细胞中的HMGB1的mRNA表达水平。引物由北京擎科生物科技有限公司长沙合成部提供,引物序列表见表 1。反应条件见表 2。
| 引物项目 | 引物序列 |
| HMGB1 Forward primer | 5 ‘-cgaaggctatcacaagaac-3’ |
| HMGB1 Reverse primer | 5 ‘-ataaagggacaaaccacag-3’ |
| GAPDH Forward primer | 5’-aacgaccccttcattgac-3’ |
| GAPDH Reverse primer | 5’-tccacgacatactcagcac-3’ |
按2.1方法处理细胞后,弃上清液,细胞裂解液和蛋白酶抑制剂cocktail以99:1的比例混匀后裂解细胞,提取细胞蛋白,BCA方法测定各样本浓度,100℃变性7 min。SDS-PAGE电泳,12%分离胶分离,湿法转膜(100 V,1 h),再用含5%(m/v)脱脂奶粉的TBST室温下摇床封闭1 h。接着将根据相对分子质量大小裁剪PVDF膜,分别浸泡至配制好的一抗溶液中(Tubulin: 一抗稀释液=1:5 000,HMGB1抗体: 一抗稀释液=1:5 000),置于4℃孵育过夜。再用1×TBST室温下洗涤PVDF膜3次,每次10 min。二抗室温下摇床孵育1 h。洗膜同上3次后发光显影。利用Image J软件进行灰度值分析。
1.7 ELISA检测上清液中的炎症因子IL-1β、IL-6和TNF-α的浓度按1.2方法处理细胞后,取上清液,根据ELISA试剂盒说明书分别对各组样本IL-1β、IL-6和TNF-α的浓度进行检测。
1.8 统计学方法实验数据用GraphPad Prism8.0.2软件进行分析。数据结果统一以均数±标准差(x±s)的形式表现。组间差异采用单因素方差分析(ANOVA),有差异后接着两两比较采用成组t检验(Student's t-test)。以P < 0.05为差异有统计学意义。
2 结果 2.1 西仑吉肽对LPS和ATP共同诱导巨噬细胞HMGB1 mRNA的表达影响与空白对照组相比,炎症模型组HMGB1 mRNA的表达水平显著升高(P < 0.01);而与炎症模型组相比,西仑吉肽干预组HMGB1 mRNA的表达量显著下降(P < 0.01)(如图 1)。西仑吉肽可以抑制LPS和ATP共同诱导巨噬细胞HMGB1 mRNA的表达。
|
| 注:aP < 0.01 图 1 比较各组HMGB1 mRNA相对表达情况) |
|
|
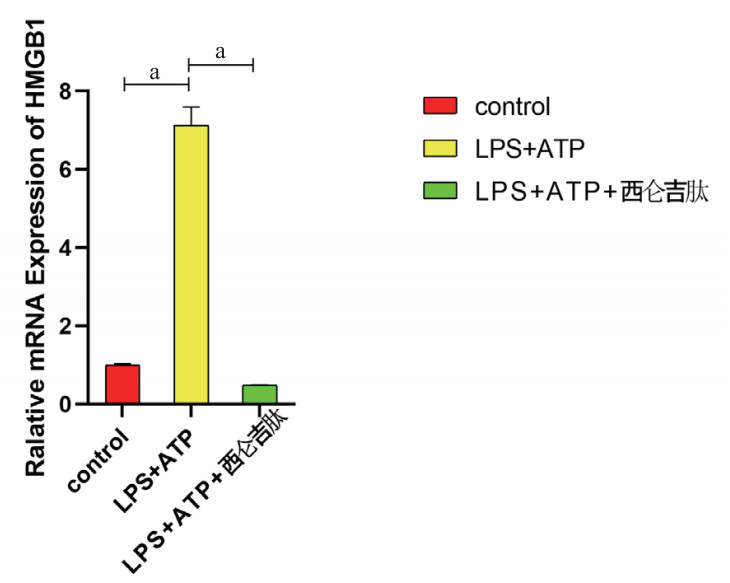
与空白对照组相比,炎症模型组HMGB1的蛋白表达水平增加(P < 0.01);而与炎症模型组相比较,西仑吉肽干预组HMGB1的蛋白表达水平显著下降(P < 0.01)(如图 2)。西仑吉肽可以降低LPS和ATP共同诱导巨噬细胞HMGB1蛋白的表达。
|
| 图 2 为各组HMGB1的蛋白显影结果 |
|
|
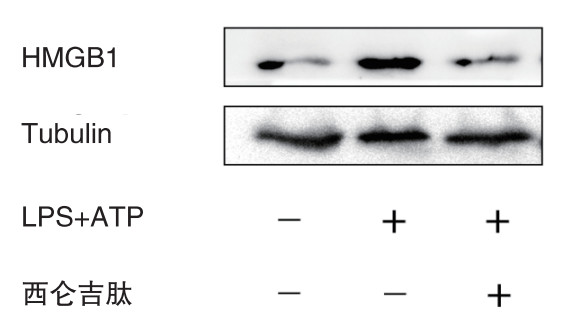
与空白对照组相比,炎症模型组和西仑吉肽干预组上清液中炎症因子IL-1β、IL-6和TNF-α的浓度均显著提高(均P < 0.01)。而与炎症模型组比较,西仑吉肽干预组上清液中炎症因子IL-1β、IL-6和TNF-α的浓度都明显减少(均P < 0.01)(如图 3)。西仑吉肽可降低LPS和ATP共同诱导小鼠巨噬细胞分泌炎症因子的浓度。
|
| 注:A:IL-1β;B:TNF-α;C:IL-6;aP < 0.01 图 3 各组上清液测炎症因子的浓度 |
|
|
HMGB1是重要的炎症介质,是脓毒症的潜在治疗靶点。先天免疫细胞如巨噬细胞的Toll样受体4(Toll-like receptor 4,TLR4)或晚期糖基化终产物受体(the receptor of advanced glycation endproducts, RAGE)等相关受体识别细菌的内毒素如LPS后,会通过某种机制刺激HMGB1增加转录水平,细胞核内的HMGB1发生乙酰化、磷酸化等修饰,随后从细胞核内易位至细胞质中,再由被动释放或主动分泌等方式,大量进入血液等细胞外液中发挥调控炎症等作用。而细胞外液的HMGB1会结合TLR4、RAGE等受体,调控免疫细胞释放炎症因子等,参与到脓毒症的免疫调节、免疫耐受等过程[15-16, 18]。越来越多研究证明,抑制HMGB1的表达、易位或其释放,以及中和其作用、促进其降解,都可能有助于脓毒症患者的存活。
整合素αvβ3和αvβ5在多种细胞表达,其结合配体含有精氨酸-甘氨酸-天冬氨酸序列(Arg-Gly-Asp,RGD)。多项研究表明,细菌侵入人体后,可以通过结合整合素αvβ3,导致内皮细胞功能紊乱,通透性下降,甚至内皮细胞凋亡,血管屏障功能丧失,引起液体在组织中聚集,出现水肿、血压下降等,以及导致血小板聚集,发生DIC。在脓毒症小鼠模型或体外模型中予以整合素αvβ3拮抗剂西仑吉肽干预,发现可显著减少内皮细胞功能障碍、血小板清除率,导致血小板计数增加,提高了脓毒症小鼠的存活率[27, 29-30]。而Su等[31]研究发现整合素αvβ5抗体能够减弱LPS诱导的人脐静脉内皮细胞和人肺微血管内皮细胞单层跨内皮阻力变化和细胞骨架应力纤维形成,表明整合素αvβ5是脓毒症时血管内皮渗漏和内皮通透性的重要调节因子。
整合素αvβ3和αvβ5不只是参与了内皮细胞功能的调控,也参与调节免疫细胞的功能。Dash等研究发现,在脓毒症小鼠模型中流式结果显示肺部和腹膜中的巨噬细胞表达较高水平的整合素αvβ3[23]。另一项研究则指出,整合素αvβ3结合内源性骨桥蛋白(osteopontin,OPN)参与调节克氏锥虫感染小鼠后Th1和Th17细胞产生和释放细胞因子的过程[32]。研究发现脓毒症中存在一种细胞因子冷诱导RNA结合蛋白(cold-inducible RNA-binding protein, CIRP),其诱导的中性粒细胞细胞外陷阱(neutrophil extracellular traps, NETs)含有中性粒细胞弹性蛋白酶(neutrophil elastase, NE),NE通过切割巨噬细胞表面整合素αvβ3和αvβ5而显著抑制其胞葬作用。可见整合素αvβ3和αvβ5很可能是脓毒症中潜在的治疗靶点。
本研究发现,整合素αvβ3和αvβ5拮抗剂西仑吉肽预处理巨噬细胞后,能够显著降低LPS和ATP共同诱导的巨噬细胞HMGB1的mRNA及其蛋白表达水平,也可减少巨噬细胞释放炎症因子的浓度,起到抑制细胞炎症反应的作用。这与周慧婷等研究结果相一致:其发现小鼠巨噬细胞中整合素CD11b的药理学阻断和基因敲除阻碍了LPS刺激的HMGB1核质易位和细胞外释放,改善了脓毒症小鼠的存活率。
沉默整合素CD11b后中断了HMGB1与核输出因子染色体区域维持1或经典蛋白激酶C的相互作用,抑制了经典蛋白激酶C诱导的HMGB1磷酸化,这是阻断整合素CD11b抑制诱导的HMGB1核质易位和随后的细胞外释放的潜在机制[28]。不同的是,本研究则发现拮抗整合素αvβ3和(或)αvβ5,可以抑制HMGB1的mRNA及其蛋白表达水平,但具体如何影响HMGB1的转录和表达的机制以及是否影响HMGB1的核质易位与细胞外释放需要更进一步的研究,而西仑吉肽在体内脓毒症中的作用也需要进一步的动物实验验证。
此外,有趣的是他们在拮抗整合素CD11b后,一方面虽然测得脓毒症小鼠血清的HMGB1浓度显著降低,但是另一方面血清中IL-6和TNF-α等炎症因子的浓度并没有显著下降。而本研究中证实,在预先予以西仑吉肽处理巨噬细胞后,干预组上清液中的炎症因子对比炎症模型组是显著降低的(均P<0.01)。也许是不同整合素介导的下游信号存在差异,或者是体内实验与体外实验的区别。
本研究的不足一是未能明确LPS和ATP共同诱导的巨噬细胞整合素αvβ3和αvβ5的变化,二是没有更进一步探究西仑吉肽调控HMGB1的分子机制,三是需要在脓毒症动物身上进行进一步的实验。
利益冲突 所有作者声明无利益冲突
作者贡献声明 任当营:实验设计、操作、分析以及论文撰写;李湘民:获取研究经费、实验设计指导、论文修改
| [1] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [2] | Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [3] | Schortgen F, Asfar P. Update in sepsis and acute kidney injury 2014[J]. Am J Respir Crit Care Med, 2015, 191(11): 1226-1231. DOI:10.1164/rccm.201502-0307UP |
| [4] | 白丽爽, 王兴义, 杨立山. 多发伤并发脓毒血症风险的列线图模型构建[J]. 中华急诊医学杂志, 2024, 33(1): 65-69. DOI:10.3760/cma.j.issn.1671-0282.2024.01.011 |
| [5] | 刘辉, 童森, 姚咏明. 脓毒症亚型研究的现状与展望[J]. 中华急诊医学杂志, 2025, 34(2): 129-133. DOI:10.3760/cma.j.issn.1671-0282.2025.02.001 |
| [6] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [7] | Kwizera A, Urayeneza O, Mujyarugamba P, et al. Epidemiology and outcome of sepsis in adults and children in a rural, sub-Sahara African setting[J]. Crit Care Explor, 2021, 3(12): e0592. DOI:10.1097/CCE.0000000000000592 |
| [8] | Darbà J, Marsà A. Epidemiology, management and costs of sepsis in Spain (2008-2017): a retrospective multicentre study[J]. Curr Med Res Opin, 2020, 36(7): 1089-1095. DOI:10.1080/03007995.2020.1760809 |
| [9] | Caraballo C, Jaimes F. Organ dysfunction in sepsis: an ominous trajectory from infection to death[J]. Yale J Biol Med, 2019, 92(4): 629-640. |
| [10] | Kosyakovsky LB, Angriman F, Katz E, et al. Association between sepsis survivorship and long-term cardiovascular outcomes in adults: a systematic review and meta-analysis[J]. Intensive Care Med, 2021, 47(9): 931-942. DOI:10.1007/s00134-021-06479-y |
| [11] | Prescott HC, Osterholzer JJ, Langa KM, et al. Late mortality after sepsis: propensity matched cohort study[J]. BMJ, 2016, 353: i2375. DOI:10.1136/bmj.i2375 |
| [12] | van der Poll T, van de Veerdonk FL, Scicluna BP, et al. The immunopathology of sepsis and potential therapeutic targets[J]. Nat Rev Immunol, 2017, 17(7): 407-420. DOI:10.1038/nri.2017.36 |
| [13] | Wei JX, Jiang HL, Chen XH. Endothelial cell metabolism in sepsis[J]. World J Emerg Med, 2023, 14(1): 10-16. DOI:10.5847/wjem.j.1920-8642.2023.019 |
| [14] | Alharbi AS, Sanyi RH, Azhar EI. Bacteria and host: what does this mean for sepsis bottleneck?[J]. World J Emerg Med, 2025, 16(1): 10-17. DOI:10.5847/wjem.j.1920-8642.2025.001 |
| [15] | Deng MH, Scott MJ, Fan J, et al. Location is the key to function: HMGB1 in sepsis and trauma-induced inflammation[J]. J Leukoc Biol, 2019, 106(1): 161-169. DOI:10.1002/JLB.3MIR1218-497R |
| [16] | Deng C, Zhao L, Yang Z, et al. Targeting HMGB1 for the treatment of sepsis and sepsis-induced organ injury[J]. Acta Pharmacol Sin, 2022, 43(3): 520-528. DOI:10.1038/s41401-021-00676-7 |
| [17] | Zhu CS, Wang W, Qiang XL, et al. Endogenous regulation and pharmacological modulation of sepsis-induced HMGB1 release and action: an updated review[J]. Cells, 2021, 10(9): 2220. DOI:10.3390/cells10092220 |
| [18] | Xue JM, Suarez JS, Minaai M, et al. HMGB1 as a therapeutic target in disease[J]. J Cell Physiol, 2021, 236(5): 3406-3419. DOI:10.1002/jcp.30125 |
| [19] | Wang H, Bloom O, Zhang M, et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999, 285(5425): 248-251. DOI:10.1126/science.285.5425.248 |
| [20] | Hynes RO. Integrins: bidirectional, allosteric signaling machines[J]. Cell, 2002, 110(6): 673-687. DOI:10.1016/s0092-8674(02)00971-6 |
| [21] | Kadry YA, Calderwood DA. Chapter 22: Structural and signaling functions of integrins[J]. Biochim Biophys Acta Biomembr, 2020, 1862(5): 183206. DOI:10.1016/j.bbamem.2020.183206 |
| [22] | Pan L, Zhao Y, Yuan ZJ, et al. Research advances on structure and biological functions of integrins[J]. Springerplus, 2016, 5(1): 1094. DOI:10.1186/s40064-016-2502-0 |
| [23] | Dash SP, Chakraborty P, Sarangi PP. Inflammatory monocytes and subsets of macrophages with distinct surface phenotype correlate with specific integrin expression profile during murine sepsis[J]. J Immunol, 2021, 207(11): 2841-2855. DOI:10.4049/jimmunol.2000821 |
| [24] | Singh B, Janardhan KS, Kanthan R. Expression of angiostatin, integrin alphavbeta3, and vitronectin in human lungs in sepsis[J]. Exp Lung Res, 2005, 31(8): 771-782. DOI:10.1080/01902140500324901 |
| [25] | Chen KH, Murao A, Arif A, et al. Inhibition of efferocytosis by extracellular CIRP-induced neutrophil extracellular traps[J]. J Immunol, 2021, 206(4): 797-806. DOI:10.4049/jimmunol.2000091 |
| [26] | McDonnell CJ, Garciarena CD, Watkin RL, et al. Inhibition of major integrin αV β3 reduces Staphylococcus aureus attachment to sheared human endothelial cells[J]. J Thromb Haemost, 2016, 14(12): 2536-2547. DOI:10.1111/jth.13501 |
| [27] | Viela F, Speziale P, Pietrocola G, et al. Mechanostability of the fibrinogen bridge between staphylococcal surface protein ClfA and endothelial cell integrin αVβ3[J]. Nano Lett, 2019, 19(10): 7400-7410. DOI:10.1021/acs.nanolett.9b03080 |
| [28] | Zhou HT, Li YH, Gui H, et al. Antagonism of integrin CD11b affords protection against endotoxin shock and polymicrobial sepsis via attenuation of HMGB1 nucleocytoplasmic translocation and extracellular release[J]. J Immunol, 2018, 200(5): 1771-1780. DOI:10.4049/jimmunol.1701285 |
| [29] | McHale TM, Garciarena CD, Fagan RP, et al. Inhibition of vascular endothelial cell leak following Escherichia coli attachment in an experimental model of sepsis[J]. Crit Care Med, 2018, 46(8): e805-e810. DOI:10.1097/CCM.0000000000003219 |
| [30] | Hakanpaa L, Kiss EA, Jacquemet G, et al. Targeting β1-integrin inhibits vascular leakage in endotoxemia[J]. Proc Natl Acad Sci USA, 2018, 115(28): E6467-E6476. DOI:10.1073/pnas.1722317115 |
| [31] | Su G, Atakilit A, Li JT, et al. Effective treatment of mouse sepsis with an inhibitory antibody targeting integrin αvβ5[J]. Crit Care Med, 2013, 41(2): 546-553. DOI:10.1097/CCM.0b013e3182711b1e |
| [32] | Santamaría MH, Corral RS. Osteopontin-dependent regulation of Th1 and Th17 cytokine responses in Trypanosoma cruzi-infected C57BL/6 mice[J]. Cytokine, 2013, 61(2): 491-498. DOI:10.1016/j.cyto.2012.10.027 |
 2025, Vol. 34
2025, Vol. 34