2. 郑州大学附属郑州中心医院呼吸重症医学科,郑州 450007
2. Respiratory Intensive Care Unit, Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450002, China
脓毒症性凝血病(sepsis-induced coagulopathy,SIC)是指感染诱导的以凝血功能紊乱为主要特征的脓毒症[1]。据报道,SIC在脓毒症患者中发生率约为21%~29%,28 d病死率可达23%~44% [2-4]。当SIC不能及时纠正时,患者可发展为弥散性血管内凝血(disseminated intravascular coagulation, DIC)和多器官功能衰竭,使患者病死率增高2倍 [5]。因此,DIC的早期识别在降低脓毒症的病死率方面至关重要。SIC的发病机制主要包括血管内皮功能障碍、组织因子等促凝物质上调、生理性抗凝机制受损和纤溶抑制[6-9]。脓毒症患者已被证实存在微循环异常,内皮细胞是微循环的重要组成部分[10-11],脓毒症发展过程中凝血功能障碍与微循环紧密相连,由于内皮细胞的受损、凝血功能障碍、血流动力学的改变以及血管反应性和自动调节的丧失,造成了脓毒症患者微循环障碍的发生。灌注血管比例(proportion of perfused vessels, PPV)是微循环中小血管的灌注长度与所有小血管长度的比值,可反映微循环的灌注质量,以及早期微循环障碍程度。既往[12]研究表明,脓毒症患者的炎症、凝血及微循环指标与预后相关。研究[13]显示SIC患者的微循环障碍发生率显著高于普通脓毒症患者,且灌注参数差异明显。尽管SIC的病理机制(如凝血紊乱、内皮损伤)已较为明确,但微循环障碍与SIC发展的动态关联仍需进一步探索。侧流暗场成像技术(SDF)作为无创检测手段,可实时监测微循环灌注状态,有助于早期识别SIC患者,为优化治疗方案、改善预后提供依据。高迁移率族蛋白B1(high mobility group box 1, HMGB1)是介导脓毒症性凝血病(SIC)的发生和发展关键炎症因子,其释放进入血后可导致机体出现高凝状态,诱发弥散性血管内凝血(DIC)形成,并导致多器官衰竭,研究[14]证实,合并凝血功能障碍的脓毒症患者血浆HMGB1水平显著升高。研究发现,在脓毒症小鼠模型中,血清HMGB1水平与D-二聚体、血小板减少等凝血异常指标呈正相关,提示其可作为凝血功能障碍的生物标志物[15]。尽管HMGB1在凝血方面发挥重要作用,但其与SIC的相关研究较少。脓毒症患者常表现为舌下微循环障碍,微循环障碍导致组织缺氧,缺氧微环境通过激活核因子NF-κB (nuclear factor kappaB,NF-κB)等通路促进HMGB1释放,形成炎症-凝血恶性循环。研究显示HMGB1水平升高与微循环参数恶化显著相关[16],提示两者联合可能提高对SIC的预测效能。
为了进一步提高对脓毒症性凝血病的早期诊断和及时干预,本研究探讨分析灌注血管比例(PPV)、高迁移率族蛋白B1(HMGB1)与SIC发生的关系。
1 资料与方法 1.1 研究对象本研究为前瞻性研究。选取2022年11月至2024年5月期间入住郑州大学附属郑州中心医院呼吸重症监护病房(RICU)的66例脓毒症患者(微循环图像清晰及血清标本完整)为研究对象。纳入标准:(1)符合国际脓毒症3.0诊断标准;年龄≥18岁,且<95岁。排除标准:(1)临床资料不完整的患者;(2)免疫性疾病、恶性肿瘤、长期使用激素、免疫抑制剂患者;(3)入组不足24 h死亡;(4)3个月内有抗凝药物服用史的患者。
1.2 伦理学本研究符合医学伦理学要求,并通过郑州大学附属郑州中心医院伦理委员会审批(审批号:202408),各种检查均获得患者或家属知情同意。
1.3 收集指标及检测方法 1.3.1 一般资料记录患者的性别、年龄、RICU住院时间、基础疾病、入住RICU确诊后SOFA评分、APACHE Ⅱ评分、血小板(PLT)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fib)、白细胞(WBC)、血肌酐(SCr)、降钙素原(PCT)、C反应蛋白(CRP)等;收集患者入住RICU确诊脓毒症后0 h、6 h的舌下微循环图像、HMGB1。
分组:根据脓毒症性凝血病诊断标准依据2019年国际血栓和止血协会公布的《脓毒症性凝血病和弥散性血管内凝血的诊断和管理》指南的诊断标准(表 1),将纳入的脓毒症患者,根据入院第1天是否发生SIC,分为SIC组(n=36)和无SIC组(n=30)。
| 指标 | 参数 | 0分 | 1分 | 2分 |
| 凝血酶原时间比率 | 国际标准化比值 | ≤1.2 | > 1.2 | > 1.4 |
| 凝血功能 | 血小板计数 | ≥150 | < 150 | < 100 |
| SOFA评分 | SOFA四项评分 | 0 | 1 | ≥2 |
| 注:SOFA为序贯器官衰竭评分 | ||||
舌下微循环PPV的检测分别于入RICU确诊脓毒症后0、6 h,使用MicroSeeV100 2.84版手持视频显微镜(广州医软智能科技有限公司)采集舌下微循环视频影像:用37℃生理盐水纱布或棉签轻柔拭去口腔及舌周分泌物后,将探针放在舌下黏膜上,调整探头的焦距,避免因为压力对微循环采集的影响。采集舌腹侧不同部位的5个视频影像,每个视频影像至少持续20 s,结果由另一名研究人员进行分析,得到PPV。
1.3.3 HMGB-1检测方法所有入组患者在入住RICU确诊脓毒症后0 h、6 h时均使用干燥管采集静脉血3 mL,静置至自然凝血,3 000 r/min离心10 min,分离出血清,取上清液置于1.5 mL EP管(爱思进生物技术(杭州)有限公司)内,冻存至-80℃低温冰箱(青岛海尔特种电器),按照酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(武汉云克隆,SEB966Hu)的说明书步骤检测HMGB1的浓度。
1.4 统计学方法采用SPSS 26.0和GraphPad Prism 8.0软件进行数据处理和图形绘制。计数资料组间差异性采用χ2检验。符合正态分布的计量资料以均数±标准差(x±s)表示,组间差异性用独立t检验,不符合正态分布的计量资料以中位数(四分位数)M(Q1,Q3)表达,采取Mann-Whitney U检验;变量间相关性分析采用Spearman相关系数;运用Logistic回归分析筛选出对脓毒症性凝血病发生有意义的指标,绘制受试者工作特征曲线(receiver opeartor characteristic curve,ROC曲线),计算曲线下面积(area under curve,AUC),以P<0.05为差异有统计学意义。
2 结果 2.1 一般资料比较最终共纳入脓毒症患者66例,其中男性45例,女性21例,年龄(68.36±13.70)岁。根据住院第1天是否发生SIC分为SIC组36例,无SIC组30例。SIC组与无SIC组间的性别、年龄、体温、心率、基础疾病、感染部位、RICU住院时间以及入住RICU确诊脓毒症时的血红蛋白、PCT、CRP、SCr的差异均无统计学意义(P>0.05)。SIC组的呼吸频率、乳酸、WBC、28 d病死率显著高于无SIC组(P<0.05)差异有统计学意义,见表 2。
| 指标 | SIC组(n=36) | 无SIC组(n=30) | χ2/t/Z值 | P值 |
| 一般情况 | ||||
| 男性a | 26(72.2) | 19(63.3) | 0.596 | 0.440 |
| 年龄c | 69.50(57.0, 75.00) | 71.00(63.75, 77.50) | -0.599 | 0.549 |
| 体温/(℃)c | 36.90(36.70, 37.80) | 37.30(36.80, 38.18) | -1.602 | 0.109 |
| 心率(次/min)c | 104.00(90.0, 118.0) | 98.00(89.75, 120.75) | -0.696 | 0.486 |
| 呼吸频率b | 21.97±5.33 | 20.44±4.94 | -2.183 | 0.033 |
| RICU住院c(d) | 14.50(9.00, 21.00) | 10.50(7.00, 21.00) | -0.870 | 0.384 |
| 基础疾病a | ||||
| 高血压 | 15(41.70) | 15(50.00) | 0.458 | 0.498 |
| 糖尿病 | 13(36.10) | 10(33.33) | 0.056 | 0.814 |
| 冠心病 | 16(44.40) | 13(43.33) | 0.008 | 0.928 |
| 慢性呼吸道疾病 | 4(0.11) | 3(10.00) | 2.733 | 0.157 |
| 感染部位(n, %)a | ||||
| 呼吸道 | 20(55.6) | 11(36.7) | 2.344 | 0.126 |
| 腹部 | 8(22.2) | 4(13.3) | 1.350 | 0.245 |
| 泌尿系统 | 4(11.1) | 9(30.3) | 3.691 | 0.055 |
| 皮肤/软组织 | 6(16.7) | 4(13.3) | 0.141 | 0.707 |
| 其他 | 3(8.3) | 1(3.3) | 0.719 | 0.397 |
| 实验室指标 | ||||
| 血培养阳性a | 7(19.4) | 5(16.7) | 0.085 | 0.771 |
| 血红蛋白(g/L)c | 84.00(72.00, 109.75) | 106.00(79.00, 130.50) | -1.411 | 0.158 |
| 乳酸(mmol/L)c | 3.50(1.98, 6.20) | 2.20(1.15, 3.30) | -2.693 | 0.007 |
| WBC(109/L)c | 13.20(8.02, 18.59) | 9.29(5.02, 14.49) | -2.160 | 0.031 |
| SCr(μmol/L)c | 89.90(61.68, 164.28) | 95.60(57.50, 136.60) | -0.501 | 0.616 |
| PCT(ng/L)c | 8.70(2.33, 70.75) | 6.15(3.53, 18.24) | -0.464 | 0.643 |
| CRP(mg/L)b | 143.73± 71.58 | 132.461±91.06. | 0.563 | 0.575 |
| 其他指标a | ||||
| 28 d病死率 | 16(44.44) | 6(30.00) | 4.400 | 0.036 |
| 注:WBC为白细胞,SCr为血肌酐,PCT为降钙素原,CRP为C反应蛋白;a为(例,%),b为x±s,c为M(Q1,Q3) | ||||
与无SIC组相比,SIC组的6 h PPV明显降低(P<0.05),6 h HMGB1明显升高(P<0.05)差异有统计学意义。而0 h PLT、6 h PLT、0 h PPV降低,0 h HMGB1升高,两组差异无统计学意义(均P>0.05)。与无SIC组相比,SIC组的24 h SOFA明显升高,且差异有统计学意义(P<0.05),24 h APACHEⅡ评分虽明显升高,但两组差异并无统计学意义(P>0.05);SIC组的0 h PT、0 h APTT、0 h INR相较无SIC组升高,差异有统计学意义(均P<0.05),而6 h PT、0 h Fib、6 h Fib、6 h INR、6 h APTT相比较差异无统计学意义(均P>0.05)。见表 3。
| 参数 | SIC组(n=36) | 无SIC组(n=30) | t/z值 | P值 |
| PPV(%) | ||||
| 0 h | 74.77±9.50 | 77.49±7.99 | -1.839 | 0.071 |
| 6 h | 68.98±13.56 | 82.86±9.44 | -3.811 | 0.001 |
| HMGB1(ng/mL) | ||||
| 0 h | 37.63±9.20 | 32.78±7.78 | 1.952 | 0.055 |
| 6 h | 41.06±8.43 | 32.61±6.67 | 4.448 | < 0.001 |
| PLT (×109/L) | ||||
| 0 h | 161.97±53.25 | 184.67±59.94 | -1.628 | 0.108 |
| 6 h | 151.22±43.42 | 174.47±55.04 | -1.918 | 0.060 |
| PT(s) | ||||
| 0 h | 14.50(14.05, 19.08) | 12.30(11.38, 14.65) | -3.961 | < 0.001 |
| 6 h | 16.61±3.41 | 14.30±7.02 | 1.732 | 0.088 |
| APTT(s) | ||||
| 0 h | 37.75(38.88, 55.90) | 34.45(30.43, 40.68) | -3.645 | 0.001 |
| 6 h | 43.70(35.88, 52.24) | 39.10(34.83, 44.55) | -1.921 | 0.055 |
| INR | ||||
| 0 h | 1.18±0.32 | 1.09±0.14 | -4.676 | < 0.001 |
| 6 h | 1.28±0.13 | 1.22±0.11 | 1.902 | 0.062 |
| Fib(g/L) | ||||
| 0 h | 4.18(3.16, 5.61) | 4.58(3.00, 7.21) | -0.773 | 0.440 |
| 6 h | 4.02(3.32, 5.66) | 4.56(3.05, 6.41) | -0.711 | 0.477 |
| 24h SOFA | 13.97±3.05 | 11.30±2.53 | 3.825 | < 0.001 |
| 24h APACHEⅡ | 23.83±5.99 | 24.60±6.14 | -0.512 | 0.611 |
| 注:PLT为血小板计数,PT为凝血酶原时间,APTT为活化部分凝血活酶时间, INR为国际标准比值,Fib为纤维蛋白原 | ||||
6 h PPV、6 h HMGB1与凝血功能变化的相关性分析(表 4):Spearman相关性分析发现,6 h PPV与凝血功能改变相关:与6 h PT(r = -0.396, P =0.001) 呈负相关,与6 h PLT (r = 0.316, P = 0.010)呈正相关,差异有统计学意义。6 h HMGB1与凝血功能改变相关:与6 h PLT(r = -0.257, P =0.037) 呈负相关,与6 h PT(r = 0.280, P = 0.023)呈正相关,差异有统计学意义。
| 指标 | 6 h PLT | 6 h PT | 6 h APTT | 6 h INR | 6 h Fib |
| 6 h PPV | |||||
| r | 0.316 | -0.396 | -0.108 | -0.193 | 0.132 |
| P | 0.010 | 0.001 | 0.387 | 0.121 | 0.290 |
| 6 h HMGB1 | |||||
| r | -0.257 | 0.280 | 0.071 | 0.167 | -0.098 |
| P | 0.037 | 0.023 | 0.569 | 0.179 | 0.432 |
多因素logistic回归分析显示,6 h PPV、6 h HMGB1、0 h APTT是影响诊断脓毒症性凝血病的相关因素(均P<0.05)。见表 5。
| 危险因素 | OR值 | 95%置信区间 | P值 |
| 6 h PPV | 0.900 | 0.830~0.976 | 0.011 |
| 6 h HMGB1 | 1.125 | 1.020~1.241 | 0.019 |
| 0 h PT | 0.958 | 0.826~1.111 | 0.573 |
| 0 h APTT | 1.076 | 1.003~1.154 | 0.042 |
| 白细胞 | 0.939 | 0.868~1.017 | 0.124 |
| 乳酸 | 1.266 | 0.964~1.661 | 0.090 |
|
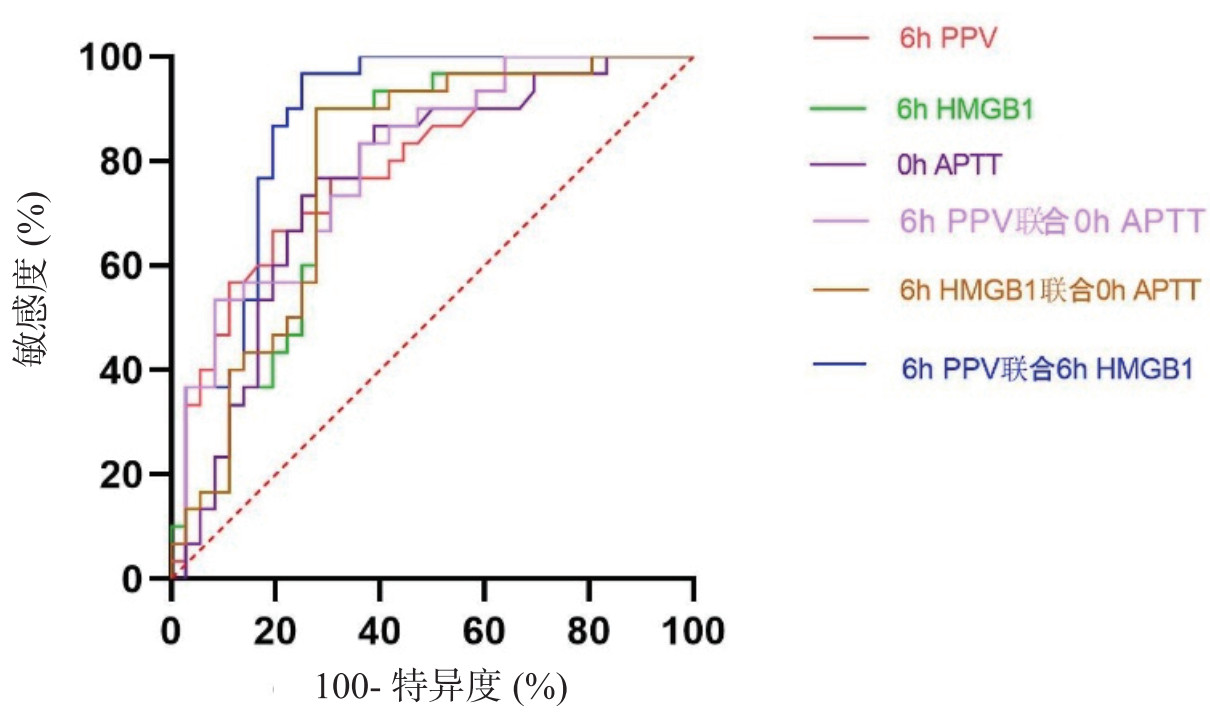
| 图 1 各指标单独及联合预测SIC的ROC曲线 Fig 1 Receiver operating characteristic (ROC) curves of individual and combined biomarkers for predicting sepsis-induced coagulopathy (SIC) |
|
|
| 检验结果变量 | 最佳截断值 | AUC | 95% CI | P值 | 敏感度(%) | 特异度(%) |
| 6 h PPV | 73.300 | 0.802 | 0.693~0.907 | < 0.001 | 70.6 | 66.7 |
| 6 h HMGB1 | 39.395 | 0.765 | 0.666~0.896 | < 0.001 | 69.4 | 90.0 |
| 0 h APTT | 38.550 | 0.732 | 0.644~0.880 | < 0.001 | 72.2 | 76.7 |
| 6 h PPV联合0 h APTT | - | 0.797 | 0.692~0.903 | < 0.001 | 63.9 | 83.3 |
| 6 h HMGB1 0 h APTT | - | 0.781 | 0.671~0.878 | < 0.001 | 72.2 | 90.0 |
| 6 h PPV联6 h HMGB1 | - | 0.873 | 0.784~0.962 | < 0.001 | 75.0 | 96.7 |
| 注:AUC:受试者工作特征曲线下面积,95% CI: 95%可信区间 | ||||||
ROC曲线显示,6 h PPV(AUC=0.802)、6 h HMGB1(AUC=0.765)、0 h APTT(AUC=0.732)、6 h PPV联合0 h APTT(AUC=0.797)、6 h HMGB1联合0 h APTT(AUC=0.781)及6 h PPV联合6 h HMGB1(AUC=0.873)对SIC均有预测价值(均P<0.05),6 h PPV联合6 h HMGB1具有最大的曲线下面积。
3 讨论脓毒症是一种由病原微生物及其产物引起的复杂的炎症紊乱综合征[17]。脓毒症性凝血病(sepsis induced coagulopathy,SIC)是脓毒症的并发症之一,当炎症因子释放入血后,全身血管内皮功能受损进而诱导凝血系统功能紊乱。凝血系统激活后,通过组织因子过度表达和纤维蛋白沉积形成微血管血栓;若凝血功能障碍持续未纠正,微血栓广泛沉积将发展为DIC,最终导致多器官衰竭[18-19]。此外,DIC已被证实是多器官功能障碍和病死率的独立预测因子[20-24]。所以,SIC的早期识别会影响脓毒症患者的治疗策略,对患者的预后有很大的帮助。由于SIC的发病机制众多,常常需要结合许多生物学指标来综合判断,但现有的常规指标无法满足简便而准确预测该疾病的发生,因此寻找能结合现有指标早期并且便捷预测SIC发生的指标,用来指导临床工作者进行该疾病的诊断变得很有意义。
本研究发现SIC组的APACHE Ⅱ评分、SOFA评分、乳酸、白细胞的水平均明显高于无SIC组,但多因素Logistic回归发现乳酸水平与白细胞计数并不是脓毒症性凝血病发生的独立相关因素,分析其原因可能是脓毒症患者会出现应激相关的肾上腺素诱导的有氧糖酵解,同时肝脏的功能障碍也会影响乳酸清除能力。同时发现SIC组患者的28 d病死率高于无SIC组患者,这与一项大规模、单中心、回顾性研究的结果是一致的[25]。本研究发现,尽管SIC组的患者在入住RICU并确诊脓毒症0 h时测得PPV水平较无SIC组患者的水平低,但两者差异无统计学意义,在入住RICU并确诊脓毒症6 h时测得的PPV差异有统计学意义,提示微循环障碍随病程进展逐渐显现。这与既往研究[13]发现SIC患者的微循环障碍普遍存在,且与普通脓毒症患者存在较大差异是一致的;原因可能是随着病情的发展,微血管的收缩和舒张功能失调,导致血流速度减慢,灌注不均。与此同时,炎症物质的大量释放,破坏了内皮细胞的完整性,进而凝血系统的异常激活,使得微血栓在微血管中形成。微血栓阻塞微血管导致有效灌注比例降低,微循环障碍加重,最终引起PPV水平的下降。这表明脓毒症患者早期舌下微循环中PPV水平的高低,在预测SIC的发生具有一定的预测价值。最终,细胞未能获得充足的氧气和营养物质,代谢产物也不能及时清除,进而加重了细胞损伤和器官功能障碍。这与本课题组既往研究[26]结果一致,该研究显示PPV变化率可预测脓毒性休克合并ARDS患者预后。
高迁移率族蛋白B1(high mobility group box protein 1, HMGB1)是一种高度保守的非组蛋白染色体结合蛋白,存在于大多数哺乳动物的细胞中。脓毒症时释放到血液循环的HMGB1作为一种“晚期”炎症因子[27-29],可引起凝血功能障碍,诱发DIC。HMGB1的促凝作用为揭示SIC的分子机制提供了新方向。脓毒症时HMGB1通过促进组织因子表达(tissue factor, TF)、增强TF活性、诱导中性粒细胞胞外诱捕网释放等机制介导了SIC的发生。本研究发现,在患者入住RICU确诊脓毒症时,SIC组的HMGB1水平稍高于无SIC组,但差异无统计学意义,在RICU确诊脓毒症6 h时,SIC组患者血清中的HMGB1水平明显高于无SIC组的患者,且二者差异有统计学意义,这是因为HMGB1作为一种“晚期”炎症因子,在脓毒症发病后6~8 h后才升高。既往研究[14]发现SIC患者的血浆HMGB1水平显著升高,这与本研究结果一致。HMGB1通过激活NF-κB及早期生长反应蛋白1(early growth respone protein1, Egr-1),促进细胞表达组织因子(tissue factor,TF),进而激活凝血级联反应。由此条通路可导致SIC的发生,另外Bongoni等[30]研究同样表明,抗HMGB1单克隆抗体可显著减少PAI-1/组织型纤溶酶原激活物(tissue-type plasminogen activator,tPA)复合物形成,抑制LPS引起的猪主动脉内皮细胞的高凝状态。实验结果提示,抗HMGB1单克隆抗体可成为缓解SIC的有效药物。因此,早期发现HMGB1升高能成为预测并治疗SIC的关键靶点。
本研究发现6 h PPV与同时间点的PLT具有良好的正相关性,6 h HMGB1与同时间点的PLT具有良好的负相关性,提示PPV下降和HMGB1升高共同促进脓毒性凝血病发生。另外,在ROC曲线中发现,当PPV水平低于73.30%,HMGB1水平高于39.395 ng/mL时,会增加SIC发生的风险。因此,关注PPV和HMGB1的水平可了解患者的凝血情况并及时地调整抗凝及治疗策略。
本研究行多因素logistic回归分析筛查发现0 h APTT的升高,6 h PPV水平下降、6 h HMGB1升高是影响SIC发生的相关因素;进一步绘制ROC曲线评估6 h PPV、6 h HMGB1及0 h APTT对SIC的预测价值,结果显示联合检测6 h PPV与6 h HMGB1具有最大曲线下面积,提示联合检测能够更好地提升检验效能。
本研究具有一定的局限性:①本研究为单中心观察性研究,且样本量偏少,结论可能存在一定的局限性。②在舌下微循环的采集方面有研究[31]发现所获取的视频当中部分存在质量问题,而导致评估可能不可靠。这需要患者的配合、软件设施的升级与操作者能力的提高等因素才能解决。③入组RICU脓毒症患者的疾病严重程度存在一定的异质性,研究结果可能存在局限性和偏倚,结论可能存在一定的局限性。
综上所述,6 h PPV下降、6 h HMGB1升高、0 h APTT升高是影响SIC发生的相关因素;联合检测6 h PPV与6 h HMGB1较单独检测可以提升检验效能。因此,监测舌下微循环PPV水平和血清HMGB1水平可为临床早期快速识别患者凝血功能状态、及时调整抗凝策略、减少多器官功能衰竭、改善患者预后提供了新的参考依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 梁煜:研究设计、收集数据、统计学分析、论文撰写;董睿、马丽:研究设计;李双凤、张瑞霞:收集数据、统计学分析;黄淑雅;李昱保:论文撰写;高延秋:研究设计、论文修改,指导支持
| [1] | Iba T, Levy JH, Warkentin TE, et al. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation[J]. J Thromb Haemost, 2019, 17(11): 1989-1994. DOI:10.1111/jth.14578 |
| [2] | Rong LF, Chen Y, Wan XX, et al. Sepsis-induced coagulopathy: the different prognosis in severe pneumonia and bacteremia infection patients[J]. Clin Appl Thromb Hemost, 2023, 29: 10760296231219249. DOI:10.1177/10760296231219249 |
| [3] | 宋景春, 张伟, 张磊. 重症患者凝血功能障碍标准化评估中国专家共识[J]. 解放军医学志, 2022, 47(2): 107-117. DOI:10.11855/j.issn.0577-7402.2022.02.0107 |
| [4] | Tsantes AG, Parastatidou S, Tsantes EA, et al. Sepsis-induced coagulopathy: an update on pathophysiology, biomarkers, and current guidelines[J]. Life (Basel), 2023, 13(2): 350. DOI:10.3390/life13020350 |
| [5] | 宋景春, 丁仁彧, 吕奔, 等. 脓毒症性凝血病诊疗中国专家共识(2024版)[J]. 解放军医学杂志, 2024, 49(11): 1221-1236. DOI:10.11855/j.issn.0577-7402.1189.2024.0918 |
| [6] | Iba T, Arakawa M, Di Nisio M, et al. Newly proposed sepsis-induced coagulopathy precedes international society on thrombosis and haemostasis overt-disseminated intravascular coagulation and predicts high mortality[J]. J Intensive Care Med, 2020, 35(7): 643-649. DOI:10.1177/0885066618773679 |
| [7] | 林青伟, 宋景春, 彭恩兰, 等. 应用甲磺酸萘莫司他治疗脓毒症性凝血病的探讨[J]. 血栓与止血学, 2023, 29(3): 138-142. DOI:10.3969/j.issn.1009-6213.2023.03.006 |
| [8] | Wei JX, Jiang HL, Chen XH. Endothelial cell metabolism in sepsis[J]. World J Emerg Med, 2023, 14(1): 10-16. DOI:10.5847/wjem.j.1920-8642.2023.019 |
| [9] | Iba T, Levy JH. Sepsis-induced coagulopathy and disseminated intravascular coagulation[J]. Anesthesiology, 2020, 132(5): 1238-1245. DOI:10.1097/ALN.0000000000003122 |
| [10] | 姬晓航, 聂时南. 糖萼在脓毒症内皮损伤中的病理生理变化及研究进展[J]. 中华急诊医学杂志, 2024, 33(8): 1204-1208. DOI:10.3760/cma.j.issn.1671-0282.2024.08.025 |
| [11] | Wang JY, Weng L, Xu J, et al. Blood gas analysis as a surrogate for microhemodynamic monitoring in sepsis[J]. World J Emerg Med, 2023, 14(6): 421-427. DOI:10.5847/wjem.j.1920-8642.2023.093 |
| [12] | 易琼, 戴飞跃, 郭志华, 等. 清瘟败毒饮对脓毒血症合并MODS兔模型PCT、HMGB1、sTREM-1、器官功能和凝血功能的影响[J]. 时珍国医国药, 2020, 31(7): 1544-1547. DOI:10.3969/j.issn.1008-0805.2020.07.003 |
| [13] | 姜紫洋, 周亚雄, 曹钰. 脓毒症相关凝血病的舌下微循环特点及炎症-凝血-微循环指标与短期预后的相关性研究[J]. 临床急诊杂志, 2025, 26(1): 24-30. DOI:10.13201/j.issn.1009-5918.2025.01.005 |
| [14] | Kuroda H, Tatsumi H, Sonoda T, et al. A suggested link between antithrombin dose and rate of recovery from disseminated intravascular coagulation in patients with severe organ failure[J]. Clin Appl Thromb Hemost, 2022, 28: 10760296221080942. DOI:10.1177/10760296221080942 |
| [15] | 龚曼芹, 王宇静, 王庆秋, 等. 脉冲高容量血液滤过对重症急性胰腺炎患者血清HMGB1的影响[J]. 中国现代医学杂志, 2018, 28(13): 45-51. |
| [16] | Yang K, Fan M, Wang XH, et al. Lactate promotes macrophage HMGB1 lactylation, acetylation, and exosomal release in polymicrobial sepsis[J]. Cell Death Differ, 2022, 29(1): 133-146. DOI:10.1038/s41418-021-00841-9 |
| [17] | Levi M, Schultz MJ. What do sepsis-induced coagulation test result abnormalities mean to intensivists?[J]. Intensive Care Med, 2017, 43(4): 581-583. DOI:10.1007/s00134-017-4725-0 |
| [18] | 陈文胜, 杨巧云, 俞建峰, 等. 早期乳酸/前白蛋白比值对脓毒症相关性肝损伤的预测价值分析[J]. 中华急诊医学杂志, 2024, 33(11): 1559-1565. DOI:10.3760/cma.j.issn.1671-0282.2024.11.015 |
| [19] | Simmons J, Pittet JF. The coagulopathy of acute sepsis[J]. Curr Opin Anaesthesiol, 2015, 28(2): 227-236. DOI:10.1097/ACO.0000000000000163 |
| [20] | Gando S, Saitoh D, Ogura H, et al. A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis[J]. Crit Care, 2013, 17(3): R111. DOI:10.1186/cc12783 |
| [21] | Ogura H, Gando S, Saitoh D, et al. Epidemiology of severe sepsis in Japanese intensive care units: a prospective multicenter study[J]. J Infect Chemother, 2014, 20(3): 157-162. DOI:10.1016/j.jiac.2013.07.006 |
| [22] | Iba T, Di Nisio M, Thachil J, et al. Revision of the Japanese Association for Acute Medicine (JAAM) disseminated intravascular coagulation (DIC) diagnostic criteria using antithrombin activity[J]. Crit Care, 2016, 20: 287. DOI:10.1186/s13054-016-1468-1 |
| [23] | 董亦鸣, 曾湘鹏, 赵会鑫, 等. 联合凝血和炎症标志物早期识别脓毒症DIC和评估预后的临床价值[J]. 中华急诊医学杂志, 2022, 31(12): 1654-1662. DOI:10.3760/cma.j.issn.1671-0282.2022.12.015 |
| [24] | 中华医学会急诊医学分会, 中华危重病急救医学杂志编辑委员会, 脓毒症并发弥散性血管内凝血诊治急诊专家共识专家组. 脓毒症并发弥散性血管内凝血诊治急诊专家共识[J]. 中华危重病急救医学, 2017, 29(7): 577-580. DOI:10.3760/cma.j.issn.2095-4352.2017.07.001 |
| [25] | Iba T, Nisio MD, Levy JH, et al. New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey[J]. BMJ Open, 2017, 7(9): e017046. DOI:10.1136/bmjopen-2017-017046 |
| [26] | 黄淑雅, 李双凤, 张磊, 等. 舌下微循环灌注血管比例变化率联合血清多配体蛋白聚糖-1水平对脓毒症休克并急性呼吸窘迫综合征预后的预测价值[J]. 郑州大学学报(医学版), 2024, 59(2): 163-167. DOI:10.13705/j.issn.1671-6825.2023.06.062 |
| [27] | Li WB, Deng MH, Loughran PA, et al. LPS induces active HMGB1 release from hepatocytes into exosomes through the coordinated activities of TLR4 and caspase-11/GSDMD signaling[J]. Front Immunol, 2020, 11: 229. DOI:10.3389/fimmu.2020.00229 |
| [28] | Kim J, Choo S, Sim H, et al. Biapenem reduces sepsis mortality via barrier protective pathways against HMGB1-mediated septic responses[J]. Pharmacol Rep, 2021, 73(3): 786-795. DOI:10.1007/s43440-020-00212-0 |
| [29] | Li JH, Zhu CS, He L, et al. A two-decade journey in identifying high mobility group box 1 (HMGB1) and procathepsin L (pCTS-L) as potential therapeutic targets for sepsis[J]. Expert Opin Ther Targets, 2023, 27(7): 575-591. DOI:10.1080/14728222.2023.2239495 |
| [30] | Bongoni AK, Klymiuk N, Wolf E, et al. Transgenic expression of human thrombomodulin inhibits HMGB1-induced porcine aortic endothelial cell activation[J]. Transplantation, 2016, 100(9): 1871-1879. DOI:10.1097/TP.0000000000001188 |
| [31] | Damiani E, Ince C, Scorcella C, et al. Impact of microcirculatory video quality on the evaluation of sublingual microcirculation in critically ill patients[J]. J Clin Monit Comput, 2017, 31(5): 981-988. DOI:10.1007/s10877-016-9924-7 |
 2025, Vol. 34
2025, Vol. 34