2. 江苏省土壤与地下水污染防控工程研究中心,南京 210036;
3. 南京医科大学公共卫生学院流行病学系,南京 211166;
4. 南京医科大学第一附属医院急诊与危重症科,南京 210029
2. Jiangsu Province Engineering Research Center of Soil and Groundwater Pollution Prevention and Control, Nanjing 210036, China;
3. Department of Epidemiology, Center for Global Health, School of Public Health, Nanjing Medical University, Nanjing 211166, China;
4. Emergency and Critical care Medicine Department, The First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China
空气污染是指室外或室内空气被物理颗粒物、化学物质或生物制剂改变其自然特性从而造成的污染。环境空气污染目前已成为全球公共卫生问题,2019年约有410万人死于室外环境空气污染,并造成1.03亿伤残调整生命年的损失[1]。此外,世界卫生组织报告说,居住在有空气质量监测系统的城市中,有80%以上的人呼吸的污染空气超过了世界卫生组织对空气质量的建议。空气质量指数包含了空气中颗粒物、二氧化氮、二氧化硫、一氧化碳和地面臭氧的含量。目前对全球公共卫生构成最大威胁的主要空气污染物是颗粒物和氮氧化物。颗粒物是通过每立方米空气中包含的颗粒质量来量化,主要包括PM2.5、PM2.5-10、PM10。颗粒物空气污染的标准在不同的国家有所区别,美国标准推荐年平均PM 2.5 < 12 μg/m3,或者日平均PM 2.5 < 35 μg/m3,欧洲标准推荐年平均PM 2.5 < 20 μg/m3,或者日平均PM 2.5 < 50 μg/m3[1]。
空气颗粒污染物对人类健康造成严重影响,PM 2.5可增加肺部感染、肺癌、慢性阻塞性肺疾病、缺血性脑卒中发生风险[2-3]。在关于心血管疾病的研究中,空气颗粒污染物对心血管系统造成损害,增加冠状动脉粥样硬化性心脏病[4, 5]、心肌梗死[6]、心力衰竭[7]、心房颤动[8]、室性心律失常[9]、外周血管疾病[10]的发生风险。PM2.5暴露每增加10 μg/m3,发生重大心血管事件的风险增加10%~20%[11]。空气污染中的NO2、NOx常常也与颗粒污染物在威胁人类健康方面有着协同作用[12]。
心源性猝死(sudden cardiac death, SCD)是一个重要的死亡原因,约占心血管疾病死亡总数的50%,它与各种因素有关,包括年龄、性别、种族、遗传、生活方式、临床合并症、情绪压力和昼夜节律[13-15]。既往的研究关于空气污染物是否增加心源性猝死的发生风险存在争议[16-17]。本研究团队开展的这项研究的目的在于评估暴露于空气污染物对心源性猝死发病的影响,以便向环境及医疗决策者提出具体建议。
1 资料与方法 1.1 一般资料本研究中使用的所有参与者数据均来自英国生物银行研究,这是一个生物医学领域的综合公共数据库。它包含了来自50万英国参与者的详细健康、遗传和环境信息,这些参与者在2006年至2010年期间参与此研究,并一直随访到现在。在此期间,参与者访问了位于英格兰、威尔士和苏格兰的22个评估中心之一,在那里他们完成了基线问卷调查,并报告了医疗状况。该研究获得了英国西北多中心研究伦理委员会的伦理批准(11/NW/0382),所有参与者都签署了书面知情同意书[18]。本研究按照UKB数据共享政策申请了相关数据,并使用了批准代码166895。笔者从研究中剔除了在基线时经历过心源性猝死事件的参与者(n=422)以及环境暴露变量和心源性猝死结局变量缺失的参与者(n=41 127),最终460 862例参与者被纳入研究,其中发生心源性猝死2 662例,未发生心源性猝死457 114例,失访1 086例。
1.2 结局事件的定义通过查询英国国家卫生服务中心登记处和死亡登记处的记录,确定了心源性猝死病例。心源性猝死是通过使用ICD-10(国际疾病分类,第10版)代码(I46.0, I46.1, I46.9)和OPCS-4(人口普查和调查办公室干预和程序分类,第4版)代码(X50.3, X50.4, X50.8, X50.9)确定的[19]。未发生心源性猝死的参与者随访至完成完全随访日期或者失访。
1.3 空气污染物的评估采用欧洲空气污染影响队列研究项目开发的土地利用回归(land use regression,LUR)模型估算PM2.5、PM10、PM2.5-10、NO2和NOx的年平均浓度[20]。利用LUR模型计算了年平均空气污染物浓度的空间变化,其中包括由地理信息系统生成的地理空间预测变量,如交通、土地利用和地形。PM2.5、PM2.5-10、PM10、NO2和NOx的年平均浓度数据采集于2010年。英国生物样本库中所有参与者的空气污染暴露情况通过基线访问时给出的居住地址与这些记录相关联[21]。2010年空气污染物的年平均浓度数据作为参与者基线时的暴露情况用于下一步的分析。
1.4 协变量的测量将年龄、性别、种族、汤森剥夺指数、受教育水平、吸烟状况、饮酒状况、身体活动、身体质量指数(BMI)、健康饮食评分作为潜在的混杂因素。采用基于短期国际体育活动问卷(international physical activity questionnaire, IPAQ)项目的代谢当量任务(metabolic equivalent task, MET)分钟数来评估身体活动。根据以下饮食因素计算健康饮食得分:蔬菜摄入量≥4汤匙/d;水果摄入量≥3片/d;鱼摄入量≥2次/周;未加工红肉摄入量≤2次/周;加工肉类摄入量≤2次/周。每个有利的饮食因素各给予1分,健康饮食评分范围为0~5分。
1.5 孟德尔随机化分析(Mendelian randomization,MR)MR分析被用于调查暴露和结局之间的关系,这可以通过利用一个或多个与暴露统计学关联强的遗传变异,如单核苷酸多态性(SNPs)来作为工具变量分析暴露与结果的关联。此外,由于基因型与结果之间存在天然的时序关系,并且基因型的分布满足孟德尔随机化原则,即父母的遗传等位基因在减数分裂过程中随机分散给后代,因此MR分析可以类比于自然界的随机对照试验其因果推断的效能高于队列研究,低于随机对照试验。基于以上特性在解释一些由于高成本或伦理问题而无法证实的因果关系问题时,MR分析也有着避免观察性研究的偏见的优势。在本研究中使用的空气污染工具变量在既往研究中被证实与其他表型没有统计学关联,满足MR的成立的独立性假设,也曾被用于解释空气污染物与心血管疾病和特异性皮炎的因果关联问题[22-23]。
1.5.1 空气污染物、心源性猝死的GWAS摘要数据NOx、NO2的全基因组关联研究(Genome-wide association studies,GWAS)摘要统计数据来自英国生物样本库,包括456 380例欧洲参与者,评估了NOx、NO2分别与单核苷酸多态性(single nucleotide polymorphisms, SNPs)之间的关联(ukb-b-12417、ukb-b-9942)。PM2.5、PM2.5-10、PM10的GWAS摘要统计数据来自英国生物样本库,包括423 796例欧洲参与者,评估了PM2.5、PM2.5-10、PM10分别与SNPs之间的关联(ukb-b-10817、ukb-b-12963、ukb-b-18469)。心源性猝死的GWAS摘要统计数据来自芬兰队列的研究,包括1 129例病例以及116 926例对照,评估了心源性猝死与SNPs之间的关联(finn-b-I9_CARDARR)。
1.5.2 选择及验证工具变量在将P值的阈值设置为5×10-8后,没有从PM2.5-10、PM10的GWAS中获得任何独立的SNPs。为了包含更多与PM10相关的SNPs,对PM2.5、PM10、NOx、NO2使用了一个更宽松的标准(P < 5×10-7),对PM2.5-10使用P < 5×10-6标准,该标准已经应用于之前的MR研究[23]。然后,笔者分析得到14个与PM2.5相关的独立SNPs、2个与PM2.5-10相关的独立SNPs、6个与PM10相关的独立SNPs、23个与NOx相关的独立SNPs、17个与NO2相关的独立SNPs;此外,为了保证工具变量满足独立性假设,进行了水平多效性检验来保证工具变量只与暴露有关,与结局和混杂没有统计学关联量。在MR分析中存在弱工具变量偏倚的可能性较低,没有SNP与心源性猝死直接相关。使用TwoSampleMR R软件包的clumping功能,以选择没有任何连锁不平衡的遗传变异(r2 < 0.001,10000kb)。此外,当F统计量大于10时,SNPs被认为足以调节潜在偏倚的影响,F统计量的计算使用以下公式:F=R2×(N-2)/(1-R2)。在MR分析中没有排除任何SNP。
1.5.3 孟德尔随机化分析本研究采用了双样本MR法。因为在大多数分析中没有发现异质性,使用固定效应模型下的逆方差加权(IVW)分析作为主要分析。此外,为了确保结果是稳健的,在随机效应模型、加权中位数和MR-Egger等方法下进行了多个互补分析。使用MR-PRESSO检验、Egger-intercept检验、leave-one-out检验进行了敏感性分析以确保MR结果可靠。Cochran Q检验主要用于检验和评价所选工具变量的异质性。进行了MR-Egger intercept检验,以检测潜在的定向多效性。当截距P值< 为0.05时,确定存在显著的多效性偏差。在进行IVW方法之前,使用MR-PRESSO方法来检测异常值。MR-PRESSO消除了异常的SNPs(异常值),以检测潜在的水平多效性,并测试校正前后的结果是否存在差异。采用leave-one-out方法分析结果的敏感性,每次依次去除一个SNP,以检验具有较大水平多效性的单个SNP是否会影响MR估计。
1.6 统计学方法连续变量(年龄、BMI、汤森剥夺指数、空气污染)采用Kruskal-Wallis检验计算两组间的分布是否差异有统计学意义,分类变量(性别、种族、教育程度、吸烟状况、饮酒情况、IPAQ身体活动情况、健康饮食)采用χ2检验计算两组间的分布是否差异有统计学意义。每个参与者的生存时间计算为从基线调查的日期到发生心源性猝死事件、完成随访或者失访的时间,以先到者为准。Cox比例风险模型用于估计风险比(HR)和95%置信区间(CI)。使用舍恩菲尔德残差检验了比例风险假设。在这些模型中调整了一些潜在的混杂因素,包括年龄、性别、种族、汤森剥夺指数、饮酒频率、吸烟状况、BMI(kg/m2)、体育活动(每周MET分钟)、健康饮食评分(0、1、2、3、4、5)。限制性立方样条图用于评估空气污染物与心源性猝死的非线性趋势以及剂量反应关系。所有分析均采用R软件(版本4.2.3)进行。所有P值均为双侧,P值< 0.05认为有统计学意义。
2 结果心源性猝死组和非心源性猝死组的基线特征见表 1。心源性猝死组的年龄(60.77岁vs. 56.53岁)、BMI(28.77 vs. 27.43)、汤森剥夺指数(-0.81 vs. -1.33)比非心源性猝死组高,发生心源性猝死的男性的占比(68.67% vs. 45.53%)、非白种人占比(6.15% vs. 5.61%)、受教育程度低占比(73.62% vs. 66.42%)、吸烟占比(17.64% vs.10.31%)、不健康饮食占比(22.44% vs. 19.55%)、运动量低占比(18.46% vs. 15.2%)均高于未发生心源性猝死组。在发生心源性猝死的参与者中,PM2.5、PM2.5-10、PM10、NO2和NOx的平均值分别为(10.1 ± 1.1)µg/m3、(6.48 ± 0.92)µg/m3、(16.35 ± 11.93)µg/m3、(27.37 ± 7.72)µg/m3、(45.42 ± 16.13)µg/m3;对于未发生心源性猝死的参与者,相应浓度为(9.99 ± 1.06)µg/m3、(6.43 ± 0.9)µg/m3、(16.24 ± 1.9)µg/m3、(26.66 ± 7.63)µg/m3、(44.02 ± 15.65)µg/m3。
| 基线特征 | 心源性猝死组(n=2, 662) | 非心源性猝死组(n=457, 114) | P值 |
| 年龄(岁) | 60.77 (6.99) | 56.53 (8.09) | < 0.001 |
| BMI(kg/m2) | 28.77 (5.39) | 27.43 (4.78) | < 0.001 |
| 汤森剥夺指数 | -0.81 (3.26) | -1.33 (3.04) | < 0.001 |
| 性别(%) | < 0.001 | ||
| 女 | 835 (31.33) | 249585 (54.47) | |
| 男 | 1830 (68.67) | 208612 (45.53) | |
| 种族(%) | 0.030 | ||
| 非白人 | 164 (6.15) | 25707 (5.61) | |
| 白人 | 2477 (92.95) | 429913 (93.83) | |
| 未知 | 24 (0.9) | 2577 (0.56) | |
| 教育(%) | < 0.001 | ||
| 大学以下 | 1962 (73.62) | 304351 (66.42) | |
| 大学 | 621 (23.3) | 144305 (31.49) | |
| 未知 | 82 (3.08) | 9541 (2.08) | |
| 吸烟状态(%) | < 0.001 | ||
| 不吸烟 | 1042 (39.1) | 249788 (54.52) | |
| 已戒烟 | 1128 (42.33) | 158445 (34.58) | |
| 目前吸烟 | 470 (17.64) | 47260 (10.31) | |
| 未知 | 25 (0.94) | 2704 (0.59) | |
| 饮酒状态(%) | < 0.001 | ||
| 低频率 | 649 (24.35) | 89923 (19.63) | |
| 中频率 | 865 (32.46) | 168308 (36.73) | |
| 高频率 | 1137 (42.66) | 198594 (43.34) | |
| 未知 | 14 (0.53) | 1372 (0.3) | |
| 健康饮食(%) | < 0.001 | ||
| 不健康 | 598 (22.44) | 89576 (19.55) | |
| 健康 | 1568 (58.84) | 293389 (64.03) | |
| 未知 | 499 (18.72) | 75232 (16.42) | |
| 身体活动(%) | < 0.001 | ||
| 低 | 492 (18.46) | 69656 (15.2) | |
| 中 | 833 (31.26) | 148676 (32.45) | |
| 高 | 724 (27.17) | 148257 (32.36) | |
| 未知 | 616 (23.11) | 91608 (19.99) | |
| 空气污染 | |||
| PM2.5(µg/m3) | 10.1 (1.1) | 9.99 (1.06) | < 0.001 |
| PM2.5-10(µg/m3) | 6.48 (0.92) | 6.43 (0.9) | < 0.001 |
| PM10(µg/m3) | 16.35 (1.93) | 16.24 (1.9) | 0.005 |
| NO2(µg/m3) | 27.37 (7.72) | 26.66 (7.63) | < 0.001 |
| NOx(µg/m3) | 45.42 (16.13) | 44.02 (15.65) | < 0.001 |
| 注:BMI,身体质量指数;PM2.5,颗粒污染物2.5;PM2.5-10,颗粒污染物2.5-10;PM10,颗粒污染物10;NO2,二氧化氮;NOx,氮氧化物 | |||
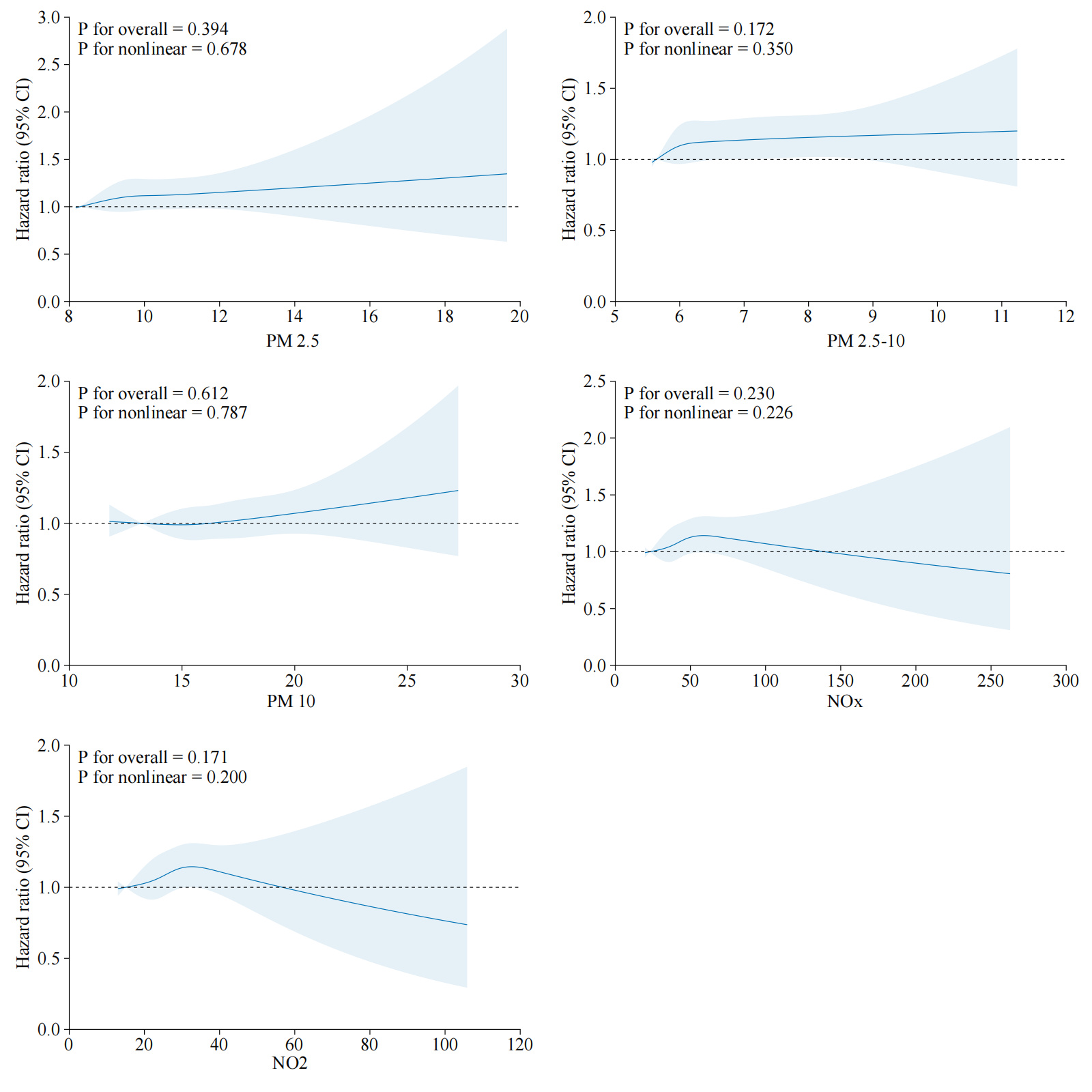
在平均12.4年的随访中,共有2 662例心源性猝死病例发生。空气污染物与心源性猝死之间的关系如表 2所示。在模型1中,校正了年龄、性别、种族后,PM2.5(HR=1.12,95%CI: 1.08~1.16,P < 0.001)、PM2.5-10(HR=1.06,95%CI: 1.02~1.11,P=0.003)、PM10(HR=1.04,95%CI: 1.02~1.06,P < 0.001)、NOx(HR=1.01,95%CI: 1.00~1.01,P < 0.001)、NO2(HR=1.01,95%CI: 1.01~1.02,P < 0.001)与心源性猝死存在关联,然而模型2在模型1的基础上进一步校正了BMI、汤森剥夺指数、IPAQ、饮酒、吸烟、教育、饮食后,PM2.5(HR=1.03,95%CI: 0.99~1.07,P=0.14)、PM2.5-10(HR=1.04,95%CI: 1.00~1.08,P=0.08)、PM10(HR=1.01,95%CI: 0.99~1.03,P=0.26)、NOx(HR= 1.00,95%CI: 0.99~1.00,P=0.26)、NO2(HR=1.00,95%CI: 1.00~1.01,P=0.19)与心源性猝死不存在关联。进一步将空气污染物由低浓度到高浓度分为了五分位数区间,发现虽然随着空气污染物浓度的增加,心源性猝死发生的风险比呈现出上升趋势,但均差异无统计学意义(表 3)。为了进一步评估空气污染物与心源性猝死之间的剂量反应关系以及是否存在非线性趋势,使用了限制性立方样条图,结果发现空气污染物与心源性猝死之间不存在非线性关联(PM2.5,P=0.39;PM2.5-10,P=0.17;PM10,P=0.61;NOx,P=0.23;NO2,P=0.17)(图 1)。
| 指标 | 模型1 | 模型2 | |||||
| 风险比(HR) | 95%CI | P值 | 风险比(HR) | 95%CI | P值 | ||
| PM2.5 | 1.12 | 1.08~1.16 | < 0.001 | 1.03 | 0.99~1.07 | 0.14 | |
| PM2.5-10 | 1.06 | 1.02~1.11 | 0.003 | 1.04 | 1.00~1.08 | 0.08 | |
| PM10 | 1.04 | 1.02~1.06 | < 0.001 | 1.01 | 0.99~1.03 | 0.26 | |
| NOx | 1.01 | 1.00~1.01 | < 0.001 | 1.00 | 0.99~1.00 | 0.26 | |
| NO2 | 1.01 | 1.01~1.02 | < 0.001 | 1.00 | 1.00~1.01 | 0.19 | |
| 注:模型1:校正年龄、性别、种族;模型2:校正年龄、性别、种族、BMI、汤森剥夺指数、IPAQ、饮酒、吸烟、教育、饮食 | |||||||
| 指标 | 空气污染物的五分位数区间 | ||||
| Q1 | Q2 | Q3 | Q4 | Q5 | |
| PM2.5 | Ref. | 1.02 (0.90~1.16) | 1.08 (0.95~1.23) | 1.06 (0.94~1.21) | 1.09 (0.95~1.24) |
| PM2.5-10 | Ref. | 1.07 (0.95~1.22) | 1.11 (0.98~1.26) | 1.14 (1.00~1.29) | 1.13 (1.00~1.28) |
| PM10 | Ref. | 0.97 (0.86~1.10) | 1.01 (0.89~1.14) | 1.04 (0.92~1.18) | 1.05 (0.93~1.19) |
| NOx | Ref. | 1.03 (0.91~1.17) | 1.08 (0.95~1.22) | 1.13 (1.00~1.28) | 1.09 (0.95~1.25) |
| NO2 | Ref. | 1.05(0.92~1.19) | 1.06(0.94~1.20) | 1.14(1.00~1.29) | 1.07 (0.93~1.23) |
|
| 图 1 限制性立方样条图展示了空气污染物(PM2.5、PM2.5-10、PM10、NOx、NO2)与心源性猝死之间的非线性关联 Fig 1 Restricted cubic spline curves illustrating the nonlinear associations between air pollutants (PM2.5, PM2.5-10, PM10, NOx, NO2) and sudden cardiac death. |
|
|
为了避免观察性研究带来的偏倚,且鉴于对空气污染物与心源性猝死的关联进行随机对照试验存在较大困难,为了进一步评估空气污染物对心源性猝死的因果关联,进行了孟德尔随机化分析。MR分析可以通过利用一个或多个遗传变异(SNPs),调查暴露和结果之间稳健的因果关系。选取了14个PM2.5的SNPs、23个PM2.5-10的SNPs、6个PM10的SNPs、23个NOx的SNPs、17个NO2的SNPs作为工具变量,MR分析的结果显示PM2.5(β=-0.149,P=0.90)、PM2.5-10(β=0.387,P=0.62)、PM10(β=-0.994,P=0.62)、NOx(β=-0.005,P=0.99)、NO2(β=-0.827,P=0.25)与心源性猝死之间均无因果关联,这与我们的观察性研究的数据结果相符合。
| 空气污染物 | 方法 | SNP数量 | Beta | Se | P值 |
| PM2.5 | MR Egger | 14 | -1.978 | 1.564 | 0.230 |
| PM2.5 | Weighted median | 14 | -1.108 | 0.849 | 0.192 |
| PM2.5 | IVW | 14 | -0.149 | 1.209 | 0.902 |
| PM2.5 | Simple mode | 14 | -1.074 | 1.666 | 0.530 |
| PM2.5 | Weighted mode | 14 | -1.074 | 0.801 | 0.203 |
| PM2.5-10 | MR Egger | 23 | -0.039 | 1.144 | 0.973 |
| PM2.5-10 | Weighted median | 23 | 0.491 | 0.833 | 0.556 |
| PM2.5-10 | IVW | 23 | 0.387 | 0.789 | 0.624 |
| PM2.5-10 | Simple mode | 23 | 0.725 | 2.000 | 0.721 |
| PM2.5-10 | Weighted mode | 23 | 0.492 | 0.834 | 0.561 |
| PM10 | MR Egger | 6 | -1.034 | 4.335 | 0.823 |
| PM10 | Weighted median | 6 | -0.381 | 2.619 | 0.884 |
| PM10 | IVW | 6 | -0.994 | 2.009 | 0.621 |
| PM10 | Simple mode | 6 | 2.190 | 3.858 | 0.595 |
| PM10 | Weighted mode | 6 | 1.719 | 3.523 | 0.646 |
| NOx | MR Egger | 23 | 0.296 | 1.315 | 0.824 |
| NOx | Weighted median | 23 | 0.105 | 1.166 | 0.928 |
| NOx | IVW | 23 | -0.005 | 0.728 | 0.995 |
| NOx | Simple mode | 23 | 0.358 | 1.843 | 0.848 |
| NOx | Weighted mode | 23 | 0.223 | 1.150 | 0.848 |
| NO2 | MR Egger | 17 | -1.315 | 1.120 | 0.259 |
| NO2 | Weighted median | 17 | -1.402 | 1.028 | 0.173 |
| NO2 | IVW | 17 | -0.827 | 0.713 | 0.246 |
| NO2 | Simple mode | 17 | -1.960 | 1.782 | 0.288 |
| NO2 | Weighted mode | 17 | -1.486 | 0.945 | 0.135 |
本研究分析了五种空气污染物(PM2.5、PM2.5-10、PM10、NOx、NO2)与心源性猝死发病风险的关联。本研究结果显示,在校正了年龄、性别、种族、汤森剥夺指数、饮酒频率、吸烟状况、BMI、体育活动、健康饮食评分后,PM2.5、PM2.5-10、PM10、NOx、NO2均不增加心源性猝死发病风险,进一步的孟德尔随机化分析也验证了这项结果。
空气污染被认为是心血管疾病的一个诱发因素。然而,关于空气污染和心搏骤停风险之间的关联的数据是有限的和有争议的。韩国一项纳入21 509例院外心搏骤停的研究显示,PM2.5每增加10 μg/m3,随后1~2 d的院外心搏骤停的发生风险增加1.3%,且两者之间存在明显的剂量反应关系,轻度的PM2.5升高(10~15 μg/m3)就可以引起明显的院外心搏骤停的发生风险增高,而PM10、NO2在校正了其他污染物后对院外心搏骤停的发生风险差异无统计学意义[24]。意大利的一项研究阐明了空气污染物和心搏骤停的急性风险之间的联系,PM2.5(OR=2.6)、PM10(OR=2.7)、NO2(OR=2.8)浓度高的日期发生院外心搏骤停的风险明显增高。心搏骤停高风险组与低风险组PM2.5(21.1 μg/m3 vs. 15.5 μg/m3)、PM10(29.6 μg/m3 vs. 24.9 μg/m3)、NO2(27.4 μg/m3 vs. 20.2 μg/m3)的浓度差异明显[25]。日本的一项研究纳入了103 189例院外目击者心搏骤停的患者,结果发现PM2.5每增加10 μg/m3,心搏骤停的风险增加1.6倍[26]。法国的一项研究纳入了启动移动ICU单元的4 558例院外心搏骤停患者,结果发现PM2.5每增加10.5 μg/m3,启动移动ICU单元的心搏骤停的风险增加1.11倍,而PM10的增高不增加心搏骤停的风险[27]。澳大利亚墨尔本的一项研究纳入了8 434例院外心搏骤停的患者,结果发现PM2.5每增加4.26 μg/m3,心搏骤停的发生风险增加3.6%,PM10也增加心搏骤停的发生风险,而NO2不增加心搏骤停发病风险[28]。另一项澳大利亚珀斯的研究8 551例院外心搏骤停的患者,结果发现PM2.5增加心搏骤停发病风险,但是PM10、NO2不增加心搏骤停发病风险[29]。美国的一项研究纳入了1 374例院外心搏骤停的患者,分析PM2.5短期暴露对心搏骤停发生率的影响,结果发现PM2.5不增加总的院外心搏骤停的发生风险,但在亚组分析中,PM2.5增加1.12倍目击者心搏骤停的发生风险[30]。瑞典斯德哥尔摩的一项研究纳入了5 973例急诊院外心搏骤停的患者,评估短期空气污染物对心搏骤停的影响,结果发现仅O3增加心搏骤停发病风险,而PM2.5、PM10、NOx均不增加心搏骤停发病风险[31]。本研究分析了空气污染物对心搏骤停的长期发病风险的影响,发现五种空气污染物(PM2.5、PM2.5-10、PM10、NOx、NO2)与心搏骤停的发病风险均没有影响,这与Raza等的研究结果有一定的相似性,而不同于大多数其他先前的研究。
空气污染物可通过增加重大心血管事件的发生风险而增加心源性猝死的长期发生风险。MESA空气污染研究发现空气污染通过脂质过氧化、系统性氧化应激、肺动脉氧化应激、炎症、自主神经功能紊乱引起引起高血压、心律失常以及冠状动脉粥样硬化性心脏病[4]。Peters等[6]研究发现交通空气污染使急性心肌梗死的发生风险增加2.92倍。Shah等[7]的研究NOx、PM2.5、PM10增加心力衰竭的住院率和病死率,其中PM2.5减少3.9 μg/m3可以预防7 978例心衰患者的住院。Peralta等[9]研究分析了176例植入埋藏式除颤器患者共1 050例室性心律失常事件,发现PM2.5暴露增加39%的心律失常风险。上述研究均提示空气污染物增加重大心血管疾病的发生风险,而这些心血管疾病是心源性猝死的潜在危险因素。然而在本研究中,五种空气污染物并没有使心源性猝死的风险增加,笔者分析可能的潜在原因为:①这五种空气污染物并不会增加心源性猝死的风险,这与之前的部分研究结果一致;②研究人群所在地区的医疗卫生条件较好,空气污染物引起的心血管疾病在良好的医疗干预下不会发展为心源性猝死;③研究人群所在地区的空气污染物的浓度没有达到能够引起心源性猝死的阈值。当然本研究也有一些优势和局限性,研究共纳入了460 862例参与者,共有2 662例心源性猝死病例发生,样本量比较大,这是研究的优势。本研究的局限性主要包括:①因影响心源性猝死的临床合并症较多且复杂,本研究在分析中未纳入临床合并症作为协变量;②UKB在2010年后未重复采集空气污染物的年平均浓度,未收集参与者的居住地址变更,未采集温度、湿度、季节等这些对空气污染物有影响的数据,这将给研究带来一定的偏倚;③本研究仅分析了5种空气污染物对心源性猝死的独立影响,未考虑到不同污染物之间协同效应。
总之,本研究发现五种空气污染物(PM2.5、PM2.5-10、PM10、NOx、NO2)均不增加心源性猝死发病风险,且进一步的孟德尔随机化分析也验证了这项结果。目前已有的研究关于空气污染物对心源性猝死的影响存在不一致的结果,未来的研究需要将空气污染数据整合到紧急医疗服务系统中,以进行更进一步的研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 潘月、张刚:论文撰写;蒋林惠、李梦雅:资料收集;王一帆:数据整理与分析;王水、戴俊程、陈旭锋:研究设计与基金支持
| [1] | Henning RJ. Particulate matter air pollution is a significant risk factor for cardiovascular disease[J]. Curr Probl Cardiol, 2024, 49(1 Pt B): 102094. DOI:10.1016/j.cpcardiol.2023.102094 |
| [2] | Wang J, Huang JN, Wang LL, et al. Urban particulate matter triggers lung inflammation via the ROS-MAPK-NF-κB signaling pathway[J]. J Thorac Dis, 2017, 9(11): 4398-4412. DOI:10.21037/jtd.2017.09.135 |
| [3] | Miller KA, Siscovick DS, Sheppard L, et al. Long-term exposure to air pollution and incidence of cardiovascular events in women[J]. N Engl J Med, 2007, 356(5): 447-458. DOI:10.1056/NEJMoa054409 |
| [4] | Kaufman JD, Spalt EW, Curl CL, et al. Advances in understanding air pollution and CVD[J]. Glob Heart, 2016, 11(3): 343-352. DOI:10.1016/j.gheart.2016.07.004 |
| [5] | Yang S, Lee SP, Park JB, et al. PM2.5 concentration in the ambient air is a risk factor for the development of high-risk coronary plaques[J]. Eur Heart J Cardiovasc Imaging, 2019, 20(12): 1355-1364. DOI:10.1093/ehjci/jez209 |
| [6] | Peters A, von Klot S, Heier M, et al. Exposure to traffic and the onset of myocardial infarction[J]. N Engl J Med, 2004, 351(17): 1721-1730. DOI:10.1056/NEJMoa040203 |
| [7] | Shah ASV, Langrish JP, Nair H, et al. Global association of air pollution and heart failure: a systematic review and meta-analysis[J]. Lancet, 2013, 382(9897): 1039-1048. DOI:10.1016/S0140-6736(13)60898-3 |
| [8] | Shao QM, Liu T, Korantzopoulos P, et al. Association between air pollution and development of atrial fibrillation: a meta-analysis of observational studies[J]. Heart Lung, 2016, 45(6): 557-562. DOI:10.1016/j.hrtlng.2016.08.001 |
| [9] | Peralta AA, Link MS, Schwartz J, et al. Exposure to air pollution and particle radioactivity with the risk of ventricular arrhythmias[J]. Circulation, 2020, 142(9): 858-867. DOI:10.1161/CIRCULATIONAHA.120.046321 |
| [10] | Hoek G, Brunekreef B, Goldbohm S, et al. Association between mortality and indicators of traffic-related air pollution in the Netherlands: a cohort study[J]. Lancet, 2002, 360(9341): 1203-1209. DOI:10.1016/S0140-6736(02)11280-3 |
| [11] | Newman JD, Bhatt DL, Rajagopalan S, et al. Cardiopulmonary impact of particulate air pollution in high-risk populations: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2020, 76(24): 2878-2894. DOI:10.1016/j.jacc.2020.10.020 |
| [12] | Mainka A, Żak M. Synergistic or antagonistic health effects of long- and short-term exposure to ambient NO2 and PM2.5: a review[J]. Int J Environ Res Public Health,, 2022, 19(21): 14079. DOI:10.3390/ijerph192114079 |
| [13] | Wong CX, Brown A, Lau DH, et al. Epidemiology of sudden cardiac death: global and regional perspectives[J]. Heart Lung Circ, 2019, 28(1): 6-14. DOI:10.1016/j.hlc.2018.08.026 |
| [14] | 王乾, 赵丽. 心脏性猝死的研究进展[J]. 中华急诊医学杂志, 2021, 30(11): 1407-1409. DOI:10.3760/cma.j.issn.1671-0282.2021.11.027 |
| [15] | 张国强. 心脏骤停及心肺复苏技术的现状、挑战与机遇[J]. 中华急诊医学杂志, 2023, 32(1): 1-5. DOI:10.3760/cma.j.issn.1671-0282.2023.01.001 |
| [16] | Zhao RX, Chen S, Wang WY, et al. The impact of short-term exposure to air pollutants on the onset of out-of-hospital cardiac arrest: a systematic review and meta-analysis[J]. Int J Cardiol, 2017, 226: 110-117. DOI:10.1016/j.ijcard.2016.10.053 |
| [17] | Borchert W, Grady ST, Chen J, et al. Air pollution and temperature: a systematic review of ubiquitous environmental exposures and sudden cardiac death[J]. Curr Environ Health Rep, 2023, 10(4): 490-500. DOI:10.1007/s40572-023-00414-7 |
| [18] | Littlejohns TJ, Sudlow C, Allen NE, et al. UK Biobank: opportunities for cardiovascular research[J]. Eur Heart J, 2019, 40(14): 1158-1166. DOI:10.1093/eurheartj/ehx254 |
| [19] | Tu SJ, Gallagher C, Elliott AD, et al. Alcohol consumption and risk of ventricular arrhythmias and sudden cardiac death: an observational study of 408 712 individuals[J]. Heart Rhythm, 2022, 19(2): 177-184. DOI:10.1016/j.hrthm.2021.09.040 |
| [20] | Eeftens M, Beelen R, de Hoogh K, et al. Development of Land Use Regression models for PM2.5, PM2.5 absorbance, PM(10) and PM(coarse) in 20 European study areas; results of the ESCAPE project[J]. Environ Sci Technol, 2012, 46(20): 11195-11205. DOI:10.1021/es301948k |
| [21] | Wang MY, Zhou T, Song YZ, et al. Joint exposure to various ambient air pollutants and incident heart failure: a prospective analysis in UK Biobank[J]. Eur Heart J, 2021, 42(16): 1582-1591. DOI:10.1093/eurheartj/ehaa1031 |
| [22] | Ni Y, He A, Ye J, et al. The impact of air pollution on atopic dermatitis: a transethnic Mendelian randomization study[J]. J Eur Acad Dermatol Venereol, 2024, 38(7): e554-e556. DOI:10.1111/jdv.19675 |
| [23] | Wang QB, Wang ZM, Chen MY, et al. Causality of particulate matter on cardiovascular diseases and cardiovascular biomarkers[J]. Front Public Health, 2023, 11: 1201479. DOI:10.3389/fpubh.2023.1201479 |
| [24] | Kang SH, Heo J, Oh IY, et al. Ambient air pollution and out-of-hospital cardiac arrest[J]. Int J Cardiol, 2016, 203: 1086-1092. DOI:10.1016/j.ijcard.2015.11.100 |
| [25] | Gentile FR, Primi R, Baldi E, et al. Out-of-hospital cardiac arrest and ambient air pollution: a dose-effect relationship and an association with OHCA incidence[J]. PLoS One, 2021, 16(8): e0256526. DOI:10.1371/journal.pone.0256526 |
| [26] | Kojima S, Michikawa T, Matsui K, et al. Association of fine particulate matter exposure with bystander-witnessed out-of-hospital cardiac arrest of cardiac origin in Japan[J]. JAMA Netw Open, 2020, 3(4): e203043. DOI:10.1001/jamanetworkopen.2020.3043 |
| [27] | Pradeau C, Rondeau V, Lévèque E, et al. Air pollution and activation of mobile medical team for out-of-hospital cardiac arrest[J]. Am J Emerg Med, 2015, 33(3): 367-372. DOI:10.1016/j.ajem.2014.12.007 |
| [28] | Dennekamp M, Akram M, Abramson MJ, et al. Outdoor air pollution as a trigger for out-of-hospital cardiac arrests[J]. Epidemiology, 2010, 21(4): 494-500. DOI:10.1097/EDE.0b013e3181e093db |
| [29] | Straney L, Finn J, Dennekamp M, et al. Evaluating the impact of air pollution on the incidence of out-of-hospital cardiac arrest in the Perth Metropolitan Region: 2000-2010[J]. J Epidemiol Community Health, 2014, 68(1): 6-12. DOI:10.1136/jech-2013-202955 |
| [30] | Rosenthal FS, Carney JP, Olinger ML. Out-of-hospital cardiac arrest and airborne fine particulate matter: a case-crossover analysis of emergency medical services data in Indianapolis, Indiana[J]. Environ Health Perspect, 2008, 116(5): 631-636. DOI:10.1289/ehp.10757 |
| [31] | Raza A, Bellander T, Bero-Bedada G, et al. Short-term effects of air pollution on out-of-hospital cardiac arrest in Stockholm[J]. Eur Heart J, 2014, 35(13): 861-868. DOI:10.1093/eurheartj/eht489 |
 2025, Vol. 34
2025, Vol. 34