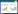迄今为止,脓毒症仍是全球范围内对人类健康最具有威胁的疾病之一[1],其特点是发病率高、病死率高以及医疗费用昂贵[2-3]。根据2016年《脓毒症和脓毒性休克第三版国际共识定义(简称sepsis 3.0)》[4],脓毒性休克被定义为脓毒症患者在充分液体复苏后,仍需血管活性药物来维持平均动脉压(mean artery pressure,MAP)≥65 mmHg以及血乳酸(lactic acid,Lac)>2 mmol/L。目前已有相关研究报道通过构建机器模型可较准确的预测脓毒症的发生[5],但少见用于预测脓毒性休克的报道[6]。近年左室压力-应变环(LV pressure-strain loops,LV-PSL)的无创心肌做功不断被应用于多种心血管疾病的诊断和预后评估中,并取得较好的临床应用效果[7]。本研究旨在运用无创心肌做功指标及临床指标等多参数构建脓毒性休克预测模型,为临床预测脓毒性休克提供量化指标,助力临床早期发现脓毒性休克并及时干预。
1 资料与方法 1.1 研究对象本研究回顾性分析2023年1月至2023年12月漳州市医院ICU收治的脓毒症患者124例,根据纳入排除标准最终纳入105例,以住院期间是否发生脓毒性休克分为未休克组(38例)和休克组(67例)。纳入标准:①入住ICU的患者(≥18岁);②符合sepsis3.0标准。排除标准:①已知左室收缩功能下降;②严重瓣膜性心脏病;③严重心律失常;④先天性心脏病;⑤心肌病;⑥心肌梗死;⑦图像质量差。本研究获医院医学伦理委员会批准(2024LWB018)。样本筛选流程图见图 1。
|
| 图 1 样本选择流程图 Fig 1 Flow chart of sample selection |
|
|
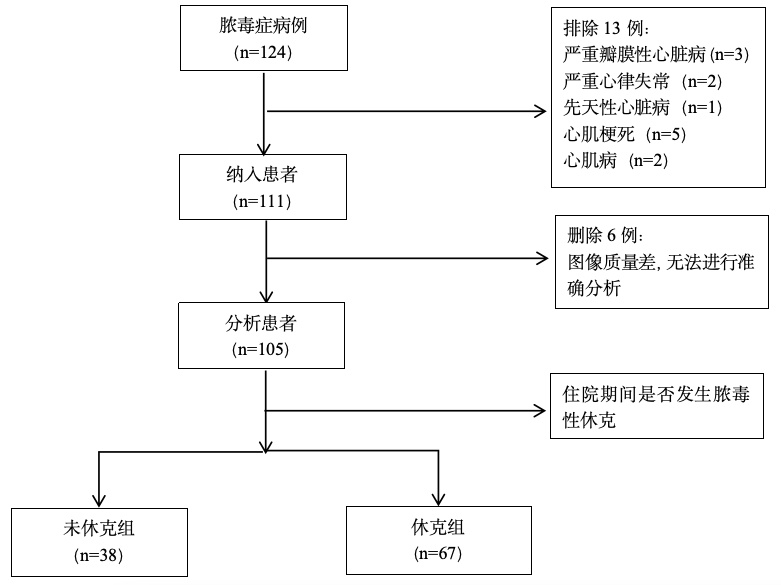
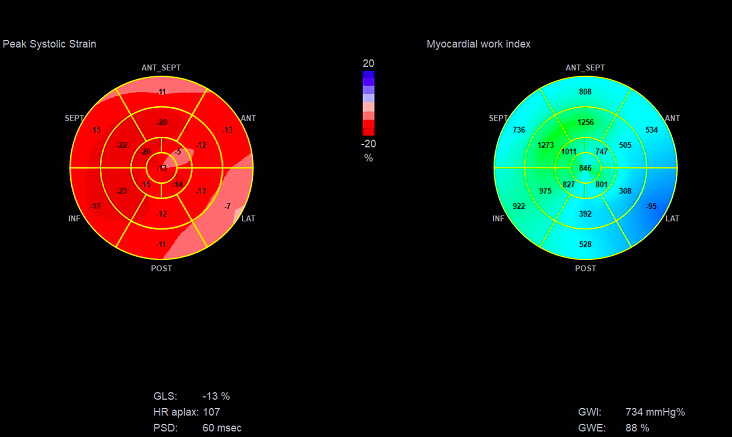
采用美国GE Healthcare Vivid IQ型超声诊断仪,使用M5Sc超声探头,频率范围2~5 MHz。受试者在入院48 h内接受超声心动图评估,取左侧卧位,连接十二导联心电图,连续记录3个以上心动周期的左室心尖四腔、三腔、两腔切面动态图像,测定左室射血分数(left ventricular ejection fraction,LVEF)。将图像导入Echo PAC工作站,选取AFI模式,系统自动生成GLS,并输入患者接受超声心动图检查时的血压值,即可获取心肌做功指标,如心肌做功指数(GWI)、心肌有效功(global constructive work,GCW)、心肌无用功(global work waste,GWW)、心肌做功效率(global work efficiency,GWE)等(见图 2、图 3)。
|
| 图 2 整体纵向应变及心肌做功指标 Fig 2 Global longitudinal strain and myocardial work indicators |
|
|
|
| 图 3 左室压力-应变环及心肌做功指标 Fig 3 Left ventricular pressure-strain loop and myocardial work indicators |
|
|
收集患者的基本信息:包括年龄、性别以及是否合并高血压、糖尿病等病史;记录入院24 h内血清肌钙蛋白、脑钠肽(brain natriuretic peptide,BNP)、降钙素原、Lac、血肌酐(creatinine,Cr)等实验室指标的最差值;记录入院24 h内MAP、呼吸、心率、氧合指数(PaO2/FiO2)以及急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation,APACHEⅡ)评分的最差值;记录血管活性药物使用情况、有创机械通气使用情况、ICU住院天数、医院住院天数、28 d生存情况。
1.3 统计学方法本研究样本量的估算由结果事件的数量决定,即根据10 EPV(10 events per variable)法则[8]来推算,在二分类结局中的阳性结果的样本量是最终纳入Logistic回归分析模型中自变量的10倍以上。本中心ICU脓毒症患病率为14.5%、脓毒性休克患病率为31.4%,预估最终纳入二元Logistic回归分析模型至少3个预测因子,估计至少需要96名患者,本研究的样本量和结果事件的数量达到10 EPV方法所估算的数量。对于缺失值,采用均值替换法进行处理。本研究应用SPSS 26.0进行数据处理与分析。连续性变量根据Shapiro-Wilk检验结果进行分布类型判断:符合正态分布的参数采用均数±标准差(x±s)表示,组间差异分析使用独立样本t检验;非正态分布变量则以中位数(四分位间距)[M(Q1,Q3)]表示,组间比较采用Wilcoxon秩和检验。分类变量采用频数(n, %)表示,根据数据分布特征选择Pearson χ2检验或Fisher精确概率法。将单因素分析有差异的结果绘制ROC曲线,寻找截断值,根据截断值将数据转换为二分类变量,各变量行相关性分析和共线性分析后,进行多因素Logistic回归分析,构建脓毒性休克风险预测模型。模型验证采用Hosmer-Lemeshow检验评估校准度。均取P < 0.05为差异具有统计学意义。
2 结果 2.1 单因素分析两组比较性别、年龄、LVEF、GWW、肌钙蛋白、降钙素原、PaO2/FiO2、糖尿病、高血压、医院住院天数等指标差异无统计学意义(P > 0.05)。两组比较GLS、GWI、GCW、GWE、BNP、Lac、Cr、MAP、呼吸、心率、APACHE Ⅱ评分、血管活性药物使用情况、有创机械通气情况、ICU住院天数、28 d生存情况等指标差异有统计学意义(P < 0.05),见表 1。
| 指标 | 未休克组(n=38) | 休克组(n=67) | P值 |
| 性别(男) | 18(47.37) | 41(61.19) | 0.170 |
| 年龄(岁) | 68(57,74) | 66(56,74) | 0.997 |
| LVEF(%) | 59(57,60) | 58(55,60) | 0.224 |
| GLS(%) | -16.58±2.66 | -14.31±1.96 | 0.000 |
| GWI(mmHg%) | 1382.84±268.73 | 1030.93±120.96 | 0.000 |
| GCW(mmHg%) | 1823.71±384.28 | 1432.93±249.66 | 0.000 |
| GWW(mmHg%) | 165.50(133.00,225.25) | 185.00(138.00,248.00) | 0.124 |
| GWE(%) | 91.19(89.08,93.27) | 88.22(85.17,91.22) | 0.000 |
| 肌钙蛋白(ng/mL) | 0.03(0.01,0.30) | 0.1(0.02,0.29) | 0.171 |
| BNP(pg/mL) | 201.50(66.74,540.23) | 389.93(216.35,868.45) | 0.008 |
| Lac(mmol/L) | 1.80(1.30,3.20) | 3.10(1.80,7.20) | 0.000 |
| 降钙素原(ng/mL) | 18.37(6.79,100) | 58.44(8.19,100) | 0.242 |
| Cr(μmol/L) | 112.85(67.30,181.33) | 176.80(110.50,237.10) | 0.010 |
| MAP(mmHg) | 72.27±8.10 | 64.49±5.81 | 0.000 |
| 呼吸(次/min) | 20(19,21) | 21(20,25) | 0.037 |
| 心率(次/min) | 92(83,109) | 108(91,119) | 0.012 |
| PaO2/FiO2(mmHg) | 247.05(193.3,402.75) | 202.7(135.1,352) | 0.091 |
| APACHEⅡ评分 | 16.5(13,21) | 20(17,24) | 0.005 |
| 血管活性药使用情况 | 0(0) | 67(100) | 0.000 |
| 有创机械通气 | 4(10.5) | 32(47.8) | 0.000 |
| 糖尿病 | 10(26.32) | 13(19.40) | 0.410 |
| 高血压 | 10(26.32) | 18(26.87) | 0.951 |
| 28 d生存情况(死亡) | 0(0.0) | 14(20.90) | 0.002 |
| ICU住院天数(d) | 6.5(3,10) | 8(5,15) | 0.032 |
| 医院住院天数(d) | 15(10,24) | 15(11,24) | 0.633 |
将单因素分析有差异的结果绘制ROC曲线,以最大约登指数所对应的截断值作为诊断截断点(见表 2)。
| 指标 | AUC | 截断值 | 敏感度 | 特异度 | 95%CI | 最大约登指数 | P值 |
| GWI(mmHg%) | 0.870 | 1196.5 | 97.0% | 68.4% | 0.795~0.945 | 0.654 | < 0.001 |
| GCW(mmHg%) | 0.793 | 1520.5 | 71.6% | 78.9% | 0.697~0.889 | 0.506 | < 0.001 |
| GWE(%) | 0.733 | 88.56 | 53.7% | 86.8% | 0.636~0.831 | 0.406 | < 0.001 |
| GLS(%) | 0.747 | -16 | 88.1% | 57.9% | 0.641~0.852 | 0.460 | < 0.001 |
| BNP(pg/mL) | 0.657 | 299.81 | 67.2% | 63.2% | 0.544~0.770 | 0.303 | 0.008 |
| Lac(mmol/L) | 0.708 | 4.75 | 35.8% | 97.4% | 0.610~0.806 | 0.332 | 0.026 |
| Cr(umol/L) | 0.652 | 103.35 | 80.6% | 50.0% | 0.539~0.764 | 0.306 | 0.010 |
| MAP(mmHg) | 0.784 | 68.5 | 79.1% | 78.9% | 0.681~0.887 | 0.581 | < 0.001 |
| APACHEⅡ评分 | 0.664 | 17 | 79.1% | 50.0% | 0.551~0.776 | 0.291 | 0.005 |
| 心率(次/min) | 0.648 | 98 | 65.7% | 63.2% | 0.536~0.760 | 0.289 | 0.012 |
| 呼吸(次/min) | 0.621 | 24 | 32.8% | 92.1% | 0.513~0.729 | 0.249 | 0.040 |
根据截断值将数据转换为二分类变量后,对各变量进行相关性分析(见图 4)和共线性分析(各变量VIF均小于5),再行多因素Logistic回归分析结果显示,GLS≥-16%、GWI < 1196.5 mmHg%、Lac≥4.75 mmol/L、BNP≥299.81 pg/ml、MAP < 68.5 mmHg是预测脓毒性休克发生的独立危险因素(见表 3)。
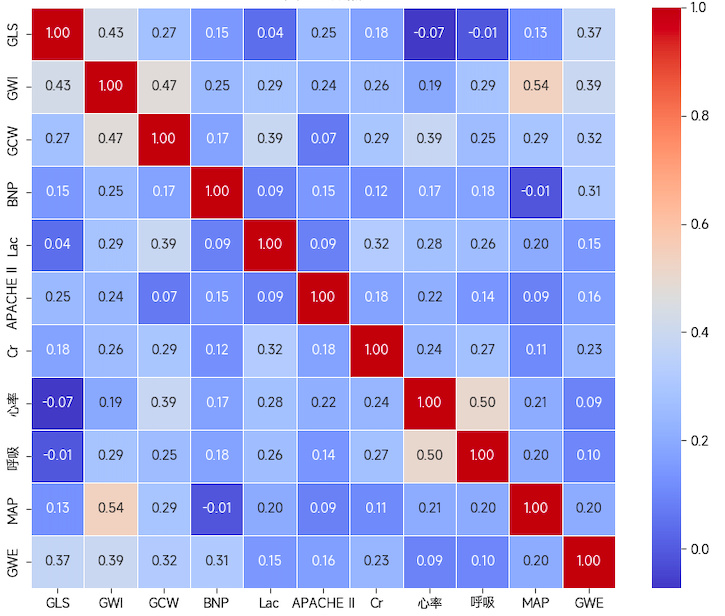
|
| 图 4 各变量相关性分析示意图 Fig 4 Schematic diagram of the correlation analysis of each variable |
|
|
| 项目 | β | SE | Z | P值 | 变量名 | OR | 95%CI | |
| 下限 | 上限 | |||||||
| GLS≥-16% | 3.517 | 1.123 | 9.802 | 0.002 | X1 | 33.671 | 3.725 | 304.341 |
| GWI < 1 196.5 mmHg% | 2.066 | 0.969 | 4.543 | 0.033 | X2 | 7.893 | 1.181 | 52.758 |
| BNP≥299.81 pg/mL | 1.941 | 0.829 | 5.483 | 0.019 | X3 | 6.964 | 1.372 | 35.346 |
| Lac≥4.75 mmol/L | 3.440 | 1.392 | 6.106 | 0.013 | X4 | 31.193 | 2.037 | 477.611 |
| MAP < 68.5 mmHg | 3.526 | 1.055 | 11.173 | 0.001 | X5 | 33.980 | 4.299 | 268.579 |
| 常量 | -21.104 | 4.658 | 20.526 | 0.000 | 0.000 | |||
依据上述回归分析结果建立预测模型,Y=-21.104+3.517×Χ1+2.066×Χ2+1.941×Χ3+3.440×Χ4+3.526×Χ5,其中Χ1为GLS≥-16%(1=是,0=否),Χ2为GWI < 1 196.5 mmHg%(1=是,0=否),Χ3为BNP≥299.81 pg/mL(1=是,0=否),Χ4为Lac≥4.75 mmol/L(1=是,0=否),Χ5为MAP < 68.5 mmHg(1=是,0=否)。ROC分析显示模型最佳诊断界值为-13.6185分,最大约登指数为0.835,AUC=0.960(95%CI=0.919-0.998)(P < 0.001),并运用Hosmer-Lemeshow进行拟合优度检验,检验结果示模型拟合良好(χ2=3.789,df=7,P=0.804)(图 5)。
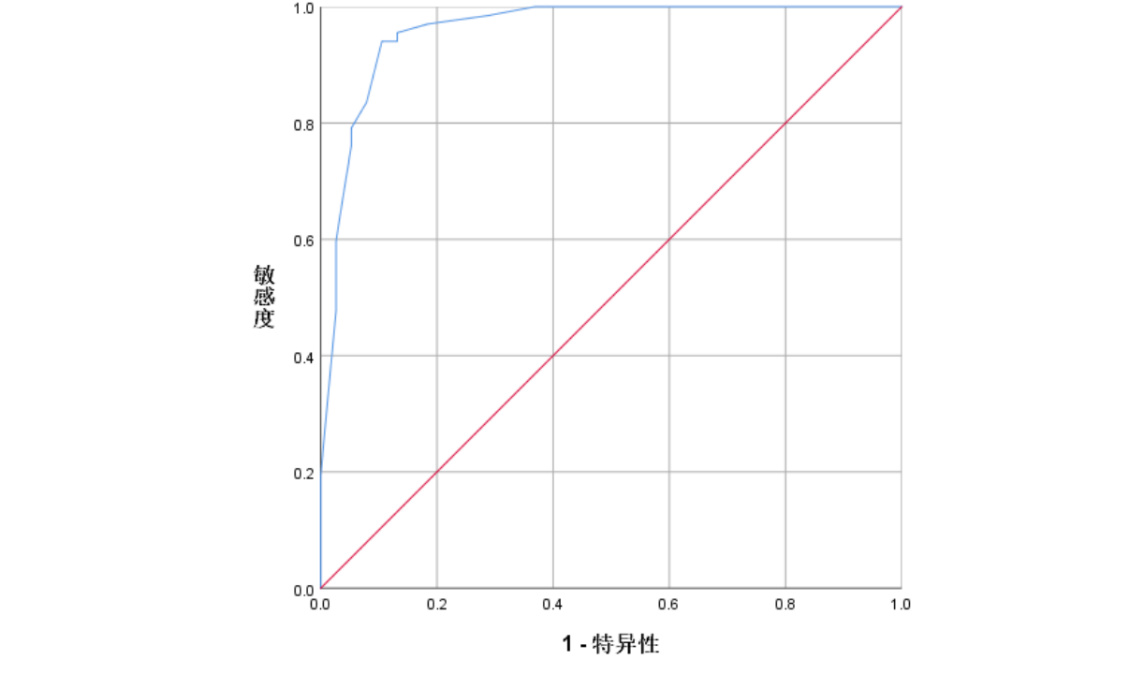
|
| 图 5 预测模型的ROC曲线 Fig 5 ROC of the prediction model |
|
|
脓毒症的病理生理机制表现为机体对感染反应失调后出现内皮功能障碍,进而引起毛细血管渗漏[9]、血管张力失调,导致绝对性和相对性的血容量不足。血容量影响前负荷,而血管扩张影响后负荷,低血容量伴血管扩张的低血压患者LVEF仍可以保持正常,在容量复苏和血管加压药物使用后,再进行超声心动图检查才可能显示左室收缩功能减低[10-11],由此可见常规的超声心动图较难检测早期左室收缩功能的真实状况[12]。近年来由斑点追踪超声心动图衍生的GLS成为检测早期左心室功能不全的准确、高灵敏度和可重复性的参数[13],其代表心内膜下纵向心肌纤维的应变,并已在某些临床应用中替代LVEF。本研究结果显示GLS≥-16%是脓毒性休克的独立危险因素,可能原因是分布于心内膜下的纵向心肌纤维更容易受到氧输送和灌注不平衡的影响[14],脓毒性休克患者血压下降,冠脉灌注不足,分布于心内膜下的纵向心肌纤维氧供不足,加之炎症引起血管渗漏出现的心肌水肿也会影响心肌顺应性和心肌功能,进而出现心肌功能受损。
基于斑点追踪超声心动图的LV-PSL技术是一种新的评估方法,其将左室后负荷纳入左室纵向应变分析中,反映了一个心动周期内左室压力与应变的变化关系,降低了后负荷对心肌的影响,进一步提高了测值的准确率[15],大多数研究[16]结果显示,与心肌应变相比,心肌做功可以更早的检测到心肌功能变化,对判断心肌功能是否出现早期损害具有重要意义。本研究结果表明GWI降低是脓毒性休克的独立危险因素,该指标反映了机械收缩期加上等容收缩期和等容舒张期的心肌做功总和,与压力应变环内的面积相对应。GWI降低可能是患者发生脓毒性休克期间出现低血压,心肌灌注明显减低,心肌细胞启动自我保护机制,自动降低了代谢能量需求,减少心肌收缩做功;同时还出现线粒体功能障碍,能量供应减少、心肌细胞收缩舒张功能下降[17-18],再者出现了内皮功能障碍,受损的血管内皮细胞释放一氧化氮[19],引起冠状动脉痉挛改变,出现微循环低灌注、外周血管阻力增加,导致心脏负荷加重、心肌氧耗增加[20];最终导致心肌整体收缩功能减低,GWI降低。
本研究还显示BNP、Lac、MAP是脓毒性休克发生的独立危险预测因子,可能与脓毒症和脓毒性休克患者体内出现微循环低灌注、毛细血管渗漏、血管舒张进而出现低血容量、低血压、心肌收缩及舒张功能障碍[21]等有关,与其他相关报道[22-28]一致。
SOFA评分、APACHEⅡ评分、英国国家早期预警评分(NEWS)等被用来筛查和早期识别脓毒症,也常被用于预测脓毒症危重患者的院内病死率,但SOFA评分、APACHEⅡ评分需要参考多项实验室结果,且这类评分系统涉及的临床指标通常范围较窄,准确性存在差异,各有其优势与不足,有可能无法全面反映脓毒症的复杂性,这种限制可能导致对患者病情的评估不全整,从而影响预测的准确性[29],因此临床工作中不应仅依赖某一种方法,需综合其他筛查结果及患者个体情况进行综合判断[30]。目前,国内外预警脓毒性休克发生的预测模型主要有基于电子病历系统的预测模型(electronic medical record system,EMR)和机器学习(machine learning, ML)模型,这两种模型需要输入大量数据,对于临床医生来说可能增加了不少的工作量。本研究首次基于上述独立危险预测因子构建脓毒性休克发生的Logistic回归模型,相比使用XGBoost算法及基于电子病历系统的脓毒性休克早期预警(Septic shock early warning,SSEW)模型而言,本模型有更高的曲线下面积(AUC=0.960),且并不依赖于专家的经验判断,且纳入的指标较少,判断更加快捷,具有较好的诊断效能,能够早期预测脓毒性休克的发生,以指导临床及时做出干预措施。本研究将心肌做功纳入到模型中,使预测模型有了更加全面的参数变量,相比Chen等[6]构建的脓毒性休克发生的Logistic回归模型(AUC=0.789),本模型有更高的曲线下面积和更好的诊断效能。
本研究存在一些局限性:仅依靠单中心小样本量进行研究,模型可能存在过拟合风险,拟后续扩大样本量、行多中心的前瞻性研究,并对模型行交叉验证,为模型的泛化能力、稳健性和临床应用价值提供重要的评估依据。GLS≥-16%、GWI < 1 196.5 mmHg%、乳酸≥4.75 mmol/L、BNP≥299.81 pg/mL、MAP < 68.5 mmHg是脓毒性休克的独立危险因素,由此构建的预测模型能够准确地预测脓毒性休克的发生,以协助临床及时做出干预措施。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赖丽玲:酝酿和设计实验、实施研究、分析解释数据、起草文章;陈宝泉:分析解释数据、对文章的知识性内容作批评性审阅;吴珠娥:收集及整理数据;周继光:数据统计学分析;佘火标:对文章的知识性内容作批评性审阅;陈明:酝酿和设计实验、对文章的知识性内容作批评性审阅、指导及修改
| [1] | 林国东, 殷冰凌, 苏磊. 基于多组学技术的脓毒症机制研究进展[J]. 中华急诊医学杂志, 2024, 33(4): 460-463. DOI:10.3760/cma.j.issn.1671-0282.2024.04.002 |
| [2] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [3] | Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority - A WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/NEJMp1707170 |
| [4] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [5] | Fleuren LM, Klausch TLT, Zwager CL, et al. Machine learning for the prediction of sepsis: a systematic review and meta-analysis of diagnostic test accuracy[J]. Intensive Care Med, 2020, 46(3): 383-400. DOI:10.1007/s00134-019-05872-y |
| [6] | Chen PL, Gao JQ, Li J, et al. Construction and efficacy evaluation of an early warning scoring system for septic shock in patients with digestive tract perforation: a retrospective cohort study[J]. Front Med (Lausanne), 2022, 9: 976963. DOI:10.3389/fmed.2022.976963 |
| [7] | 苏桥慧, 张丽萍, 梁重霄, 等. 超声压力-应变环评价诺欣妥治疗慢性心衰患者左室心肌做功改变[J]. 中国临床医学影像杂志, 2023, 34(2) 109-112, 117. DOI:10.12117/jccmi.2023.02.008 |
| [8] | Wynants L, Bouwmeester W, Moons KM, et al. A simulation study of sample size demonstrated the importance of the number of events per variable to develop prediction models in clustered data[J]. J Clin Epidemiol, 2015, 68(12): 1406-1414. DOI:10.1016/j.jclinepi.2015.02.002 |
| [9] | Wei JX, Mo HZ, Zhang YT, et al. Evolutionary trend analysis and knowledge structure mapping of endothelial dysfunction in sepsis: a bibliometrics study[J]. World J Emerg Med, 2024, 15(5): 386-396. DOI:10.5847/wjem.j.1920-8642.2024.083 |
| [10] | Ehrman RR, Sullivan AN, Favot MJ, et al. Pathophysiology, echocardiographic evaluation, biomarker findings, and prognostic implications of septic cardiomyopathy: a review of the literature[J]. Crit Care, 2018, 22(1): 112. DOI:10.1186/s13054-018-2043-8 |
| [11] | Boissier F, Razazi K, Seemann A, et al. Left ventricular systolic dysfunction during septic shock: the role of loading conditions[J]. Intensive Care Med, 2017, 43(5): 633-642. DOI:10.1007/s00134-017-4698-z |
| [12] | Ng PY, Sin WC, Ng AK, et al. Speckle tracking echocardiography in patients with septic shock: a case control study (SPECKSS)[J]. Crit Care, 2016, 20(1): 145. DOI:10.1186/s13054-016-1327-0 |
| [13] | Orde SR, Pulido JN, Masaki M, et al. Outcome prediction in sepsis: speckle tracking echocardiography based assessment of myocardial function[J]. Crit Care, 2014, 18(4): R149. DOI:10.1186/cc13987 |
| [14] | 陈傅华, 周一波, 杨道玲, 等. 超声分层应变成像技术评估急性心肌梗死患者发生主要不良心血管事件的价值研究[J]. 浙江医学, 2023, 45(23) 2496-2501, 2577. DOI:10.12056/j.issn.1006-2785.2023.45.23.2023-810 |
| [15] | Boe E, Skulstad H, Smiseth OA. Myocardial work by echocardiography: a novel method ready for clinical testing[J]. Eur Heart J Cardiovasc Imaging, 2019, 20(1): 18-20. DOI:10.1093/ehjci/jey156 |
| [16] | 范靖东, 李敏, 孙阳, 等. 超声心肌做功技术评价不同病因致左室功能受损的应用进展[J]. 临床超声医学杂志, 2023, 25(2): 137-141. DOI:10.16245/j.cnki.issn1008-6978.2023.02.020 |
| [17] | Zou RJ, Tao J, Qiu JX, et al. DNA-PKcs promotes sepsis-induced multiple organ failure by triggering mitochondrial dysfunction[J]. J Adv Res, 2022, 41: 39-48. DOI:10.1016/j.jare.2022.01.014 |
| [18] | Brealey D, Brand M, Hargreaves I, et al. Association between mitochondrial dysfunction and severity and outcome of septic shock[J]. Lancet, 2002, 360(9328): 219-223. DOI:10.1016/S0140-6736(02)09459-X |
| [19] | Hollenberg SM, Singer M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. DOI:10.1038/s41569-020-00492-2 |
| [20] | Kakihana Y, Ito T, Nakahara M, et al. Sepsis-induced myocardial dysfunction: pathophysiology and management[J]. J Intensive Care, 2016, 4: 22. DOI:10.1186/s40560-016-0148-1 |
| [21] | Bloch A, Berger D, Takala J. Understanding circulatory failure in sepsis[J]. Intensive Care Med, 2016, 42(12): 2077-2079. DOI:10.1007/s00134-016-4514-1 |
| [22] | 林笑女, 姜晓霞, 程青虹, 等. 脓毒症患者左心室舒缩功能的变化及B型钠尿肽诊断价值的探讨[J]. 中华医学杂志, 2014, 94(11): 816-820. DOI:10.3760/cma.j.issn.0376-2491.2014.11.005 |
| [23] | Pandompatam G, Kashani K, Vallabhajosyula S. The role of natriuretic peptides in the management, outcomes and prognosis of sepsis and septic shock[J]. Rev Bras Ter Intensiva, 2019, 31(3): 368-378. DOI:10.5935/0103-507X.20190060 |
| [24] | Klouche K, Pommet S, Amigues L, et al. Plasma brain natriuretic peptide and troponin levels in severe sepsis and septic shock: relationships with systolic myocardial dysfunction and intensive care unit mortality[J]. J Intensive Care Med, 2014, 29(4): 229-237. DOI:10.1177/0885066612471621 |
| [25] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [26] | Liu R, Greenstein JL, Granite SJ, et al. Data-driven discovery of a novel sepsis pre-shock state predicts impending septic shock in the ICU[J]. Sci Rep, 2019, 9(1): 6145. DOI:10.1038/s41598-019-42637-5 |
| [27] | Oh DH, Kim MH, Jeong WY, et al. Risk factors for mortality in patients with low lactate level and septic shock[J]. J Microbiol Immunol Infect, 2019, 52(3): 418-425. DOI:10.1016/j.jmii.2017.08.009 |
| [28] | Yun H, Park JH, Choi DH, et al. Enhancement in performance of septic shock prediction using national early warning score, initial triage information, and machine learning analysis[J]. J Emerg Med, 2021, 61(1): 1-11. DOI:10.1016/j.jemermed.2021.01.038 |
| [29] | Gao JY, Lu YY, Ashrafi N, et al. Prediction of sepsis mortality in ICU patients using machine learning methods[J]. BMC Med Inform Decis Mak, 2024, 24(1): 228. DOI:10.1186/s12911-024-02630-z |
| [30] | 李佳, 周人杰. 急诊重症感染的诊治策略及进展[J]. 中华急诊医学杂志, 2024, 33(6): 745-748. DOI:10.3760/cma.j.issn.1671-0282.2024.06.003 |
 2025, Vol. 34
2025, Vol. 34