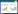2. 郑州大学第一附属医院急诊医学部EICU,郑州 450052;
3. 郑州大学第一附属医院AICU,郑州 450052;
4. 郑州大学第一附属医院RICU,郑州 450052;
5. 郑州大学第一附属医院SICU,郑州 450052;
6. 郑州大学第一附属医院NICU,郑州 450052;
7. 新乡医学院第三附属医院ICU,新乡 453000;
8. 河南省肿瘤医院ICU,郑州 450003;
9. 郑州大学第二附属医院ICU,郑州 450014
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种危及生命的非心源性肺水肿[1-2],脓毒症是ARDS常见的致病因素及死亡原因[3]。研究表明中性粒细胞产生并释放的中性粒细胞弹性蛋白酶(neutrophil elastase,NE)是脓毒症相关ARDS发病中的关键因素[3-6]。西维来司他钠是一种具有高度选择性的NE抑制剂[7-8],能直接抑制NE活化,阻止肺组织降解,还可抑制多种炎症介质释放,阻断炎症风暴[9]。该药于2020年新冠肺炎流行期间在我国紧急获批上市,但其在临床上应用的时间短,经验有限。本研究旨在评估西维来司他钠在脓毒症相关ARDS患者中应用的有效性。
1 资料与方法 1.1 研究对象本研究为前瞻性、多中心队列研究,从2021年7月20日到2022年6月30日,在河南省内14家医院重症监护室(ICU)住院的患者中,筛选脓毒症相关ARDS患者。纳入标准:(1)年龄不低于18岁;(2)在符合sepsis3.0标准[10]的基础上,符合ARDS柏林定义[11],早期诊断为脓毒症相关ARDS并接受机械通气治疗的患者;(3)签署知情同意书。排除标准:(1)存在慢性呼吸衰竭;(2)妊娠期、哺乳期或可能处于妊娠中的女性;(3)脑疝、深昏迷的患者;损害自主通气的任何神经肌肉疾病;肿瘤晚期的患者;(4)对试验药物过敏;(5)资料严重缺失的患者。本研究获得了患者的知情同意,中国临床试验注册中心注册号:ChiCTR2100049028,郑州大学第一附属医院科研项目伦理审查委员会伦理审查编号:2021-KY-0265-002。
1.2 分组与治疗基础治疗按照《拯救脓毒症运动:脓毒症和感染性休克管理国际指南》[12]进行。所有患者均进行机械通气,按照肺保护性、小潮气量通气策略[13]对呼吸机进行管理。对照组采用基础治疗。试验组在基础治疗上,加用西维来司他钠,按照药物使用说明书给予0.2 mg/(kg·h)的速度持续静脉给药,连续用药7~14 d。
1.3 数据收集收集两组患者在入组时(D0)的性别、年龄、个人史、基础疾病等一般临床资料。此外,记录患者在D0和入组D1、D2、D3、D5、D7天的氧合指数、白细胞计数(white blood cell count,WBC)、C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、SOFA评分(the sequential organ failure assessment score,SOFA),记录机械通气时间和ICU住院时间,并随访28 d生存状态。
1.4 观察终点(1)主要观察终点:D7的氧合指数;(2)次要观察终点:机械通气时间,观察期间SOFA评分、WBC、CRP、PCT水平,ICU住院时间和28 d病死率。
1.5 样本量计算及入组假设D7时试验组氧合指数较对照组升高30 mmHg,试验组与对照组按照2∶1的比例入组。设置检验水准α=0.05,把握度1-β=0.90,使用SPSS 25.0软件计算出样本量为试验组/对照组:160/80例。该试验采取竞争入组,各中心可在筛选合格受试者后自由入组试验组或对照组。
1.6 统计学方法使用SPSS 25.0软件进行统计分析。正态分布资料以均数±标准差(x±s)表示,组间采用独立样本t检验、不同时间点使用重复测量方差分析进行比较;非正态分布以中位数(下四分位数,上四分位数)[M(Q1,Q3)]表示,对应采用Wilcoxon Mann-Whitney检验和广义估计方程进行分析。分类资料采用例(%)描述,组间采用χ2检验;采用Kaplan-Meier生存曲线及Log-rank检验描述28 d生存结局。以P<0.05为具差异有统计学意义。
2 结果 2.1 基本资料入组流程见图 1,最终入组285例,按照2:1的比例匹配,试验组190例,对照组95例。所有患者年龄(56.4±13.1)岁。西维来司他钠使用时间为(8.8±2.5) d。D0时两组患者基线资料差异无统计学意义(见表 1)。
|
| 图 1 入组流程图 |
|
|
| 基线特征 | 试验组(n=190) | 对照组(n=95) | t/χ2/Z值 | P值 |
| 性别(男/女) | 134/56 | 65/30 | 0.133 | 0.715 |
| 年龄(岁,x±s) | 56.0±13.6 | 57.3±12.0 | 0.834 | 0.405 |
| 实验室指标[x±s或M(Q1,Q3)] | ||||
| WBC(×109/L) | 11.9(8.8,16.9) | 12.9(8.2,18.7) | -0.335 | 0.737 |
| CRP(mg/L) | 105.3(54.9,160.7) | 105.9(53.9,169.4) | -0.492 | 0.622 |
| PCT(μg/L) | 2.9(0.5,11.2) | 3.0(1.1,21.8) | -1.493 | 0.135 |
| PLT(×109/L) | 155.5(89.0,215.0) | 167.0(104.0,231.0) | -1.310 | 0.190 |
| TBil(μmoL/L) | 15.4(10.4,26.7) | 17.9(11.2,27.8) | -1.338 | 0.181 |
| SCr(μmol/L) | 71.5(51.8,124.0) | 87.5(59.0,145.0) | -1.874 | 0.061 |
| AST(U/L) | 44.0(25.5,91.3) | 45.0(24.0,108.0) | -0.165 | 0.869 |
| ALT(U/L) | 33.0(17.8,82.5) | 37.0(19.0,78.0) | -0.300 | 0.764 |
| ALB(g/L) | 31.2±6.2 | 31.3±6.7 | 0.106 | 0.915 |
| 氧合指数(mm Hg) | 153.2±62.0 | 157.0±62.1 | 0.492 | 0.623 |
| SOFA评分(分) | 7.7±3.0 | 8.0±3.4 | 0.865 | 0.388 |
| APACHE Ⅱ评分(分) | 15.0±4.4 | 16.1±6.0 | 1.581 | 0.116 |
| 个人史(n, %) | ||||
| 饮酒史 | 47(24.7) | 17(17.9) | 1.703 | 0.192 |
| 吸烟史 | 65(34.2) | 35(36.8) | 0.193 | 0.661 |
| 基础疾病(n, %) | ||||
| 高血压 | 81(42.6) | 49(51.6) | 2.044 | 0.153 |
| 糖尿病 | 44(23.2) | 26(27.4) | 0.606 | 0.436 |
| 冠心病 | 35(18.4) | 16(16.9) | 0.107 | 0.743 |
| 脑血管病 | 28(14.7) | 15(15.8) | 0.055 | 0.815 |
| 休克(n, %) | 77(40.5) | 36(37.9) | 0.183 | 0.669 |
| 肺部感染(n, %) | 137(72.1) | 71(74.7) | 0.222 | 0.637 |
| 注:WBC为白细胞计数;CRP为C-反应蛋白;PCT为降钙素原;PLT为血小板计数;TBil为总胆红素;SCr为血肌酐;AST为天冬氨酸转氨酶;ALT为丙氨酸转氨酶;ALB为白蛋白;SOFA评分为序贯器官衰竭评分;APACHE Ⅱ评分为急性生理学与慢性健康状况评分Ⅱ;ARDS为急性呼吸窘迫综合征 | ||||
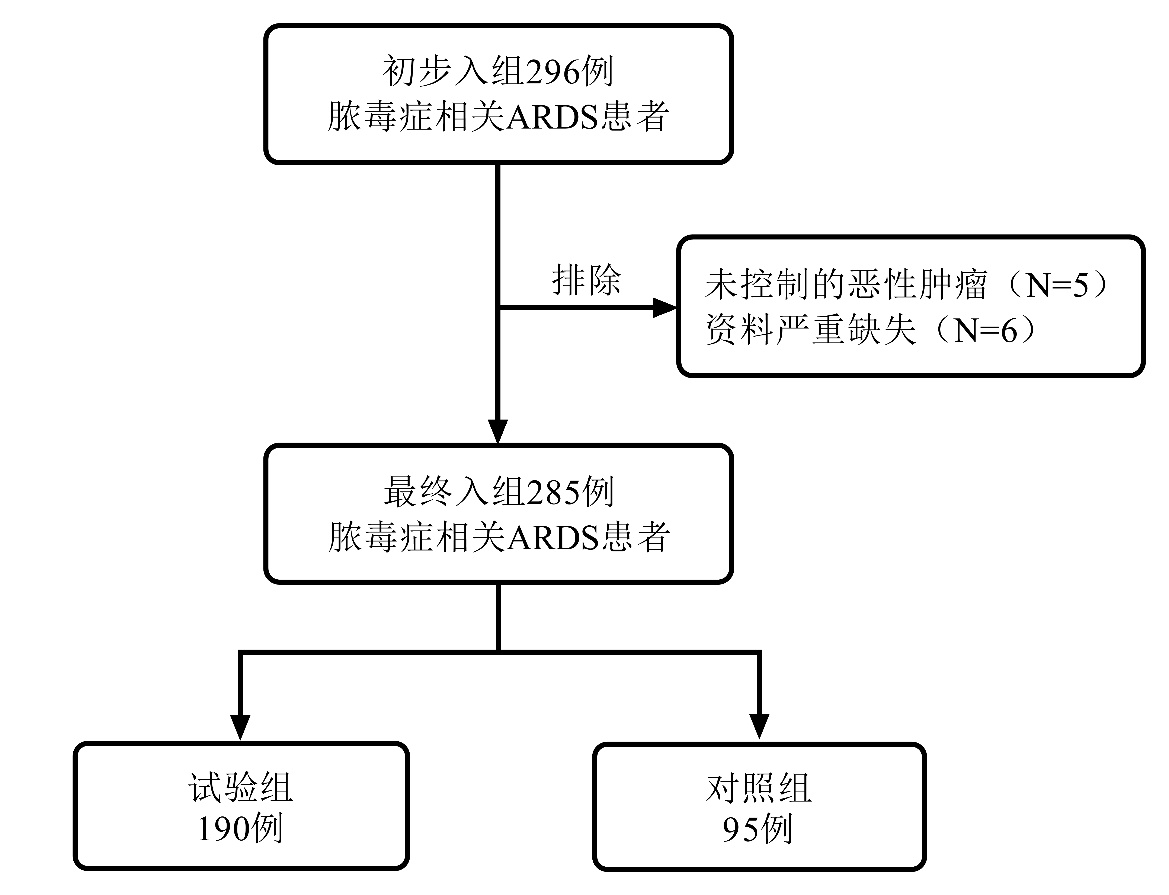
图 2所示:两组从D1到D7的氧合指数与D0相比均显著升高(试验组各时间点比较:F=110.032,P<0.001;对照组各时间点比较:F=33.521,P<0.001)。在D5和D7时,试验组的氧合指数较对照组显著升高(D5:t=-2.384,P=0.018;D7:t=-3.849,P<0.001)。
|
| 注:球形检验W 0.527,P<0.001;两组间比较, aP<0.05;与本组D0比较, bP<0.05 图 2 两组患者治疗7 d内氧合指数变化 |
|
|
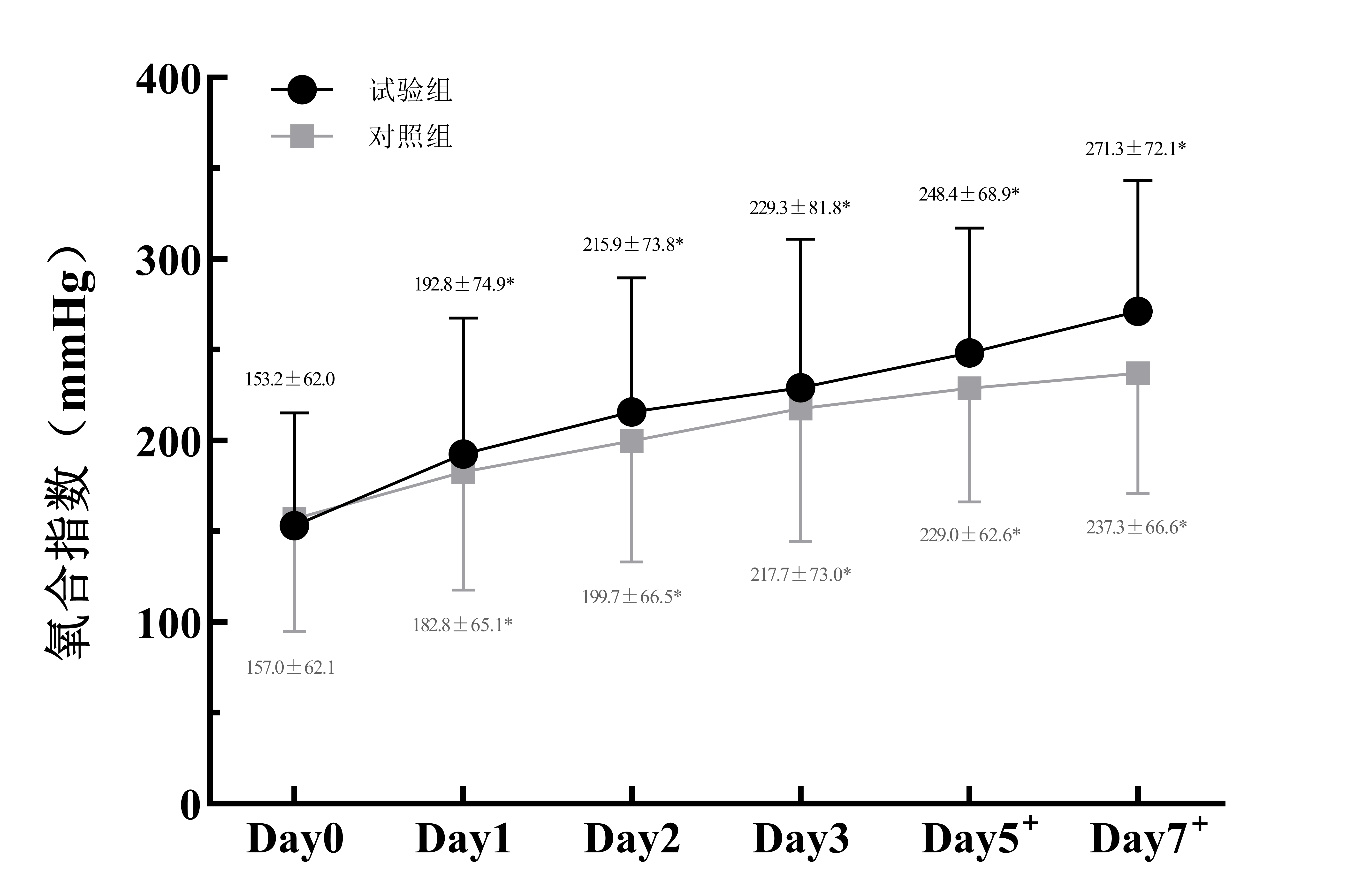
(1)图 3所示:试验组SOFA评分在D1和D7时较对照组显著降低(D1:t=2.311,P=0.022;D7:t=2.543,P=0.012)。同时,试验组SOFA评分较对照组更早改善,其在D1时较D0的差异达到统计学意义(t=4.348,P<0.001),而对照组在D3时较D0的差异有统计学意义(t=2.563,P=0.012)。
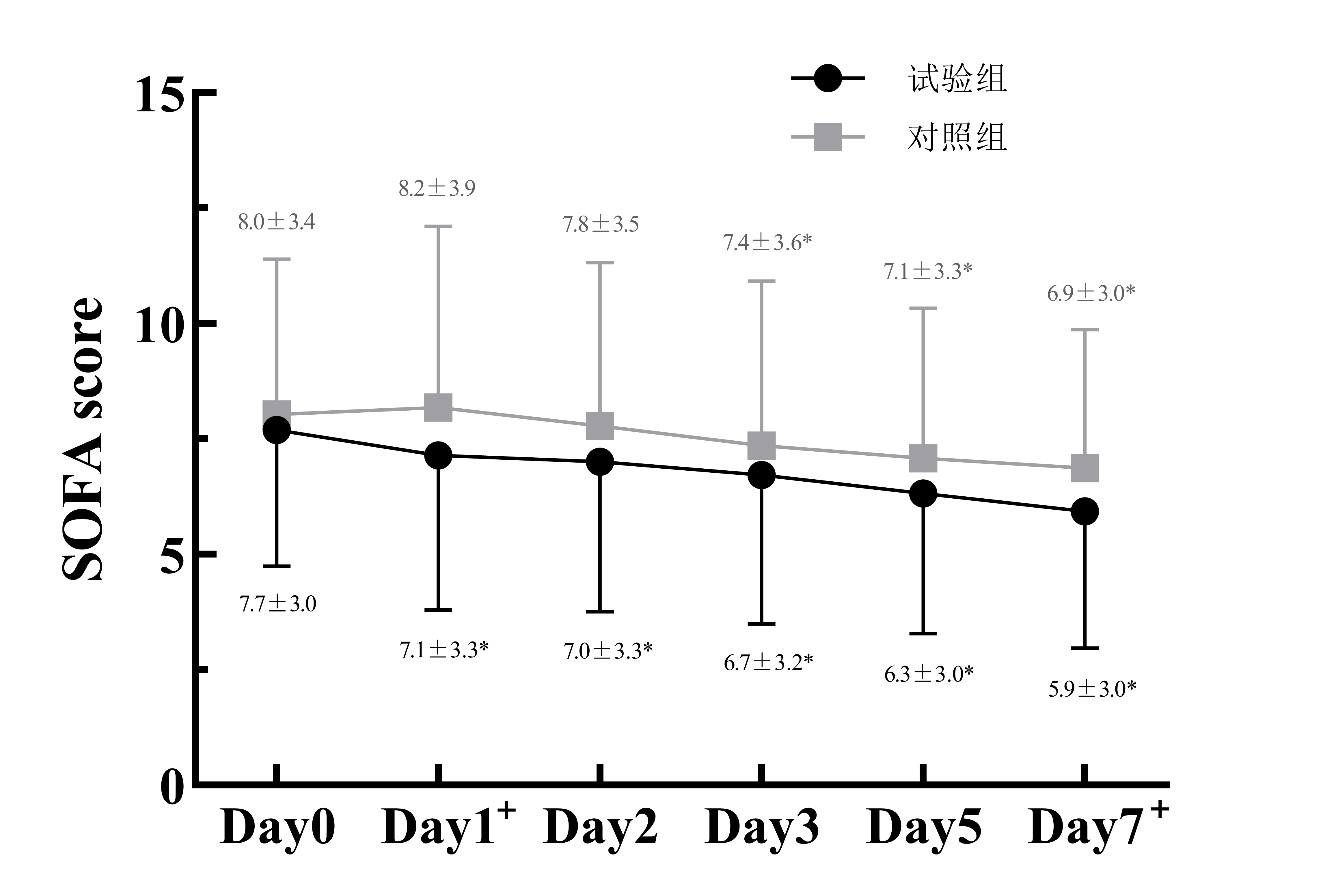
|
| 注:球形检验W=0.328,P<0.001;两组间比较, aP<0.05;与本组D0比较, bP<0.05 图 3 两组患者治疗7 d内SOFA评分变化 |
|
|
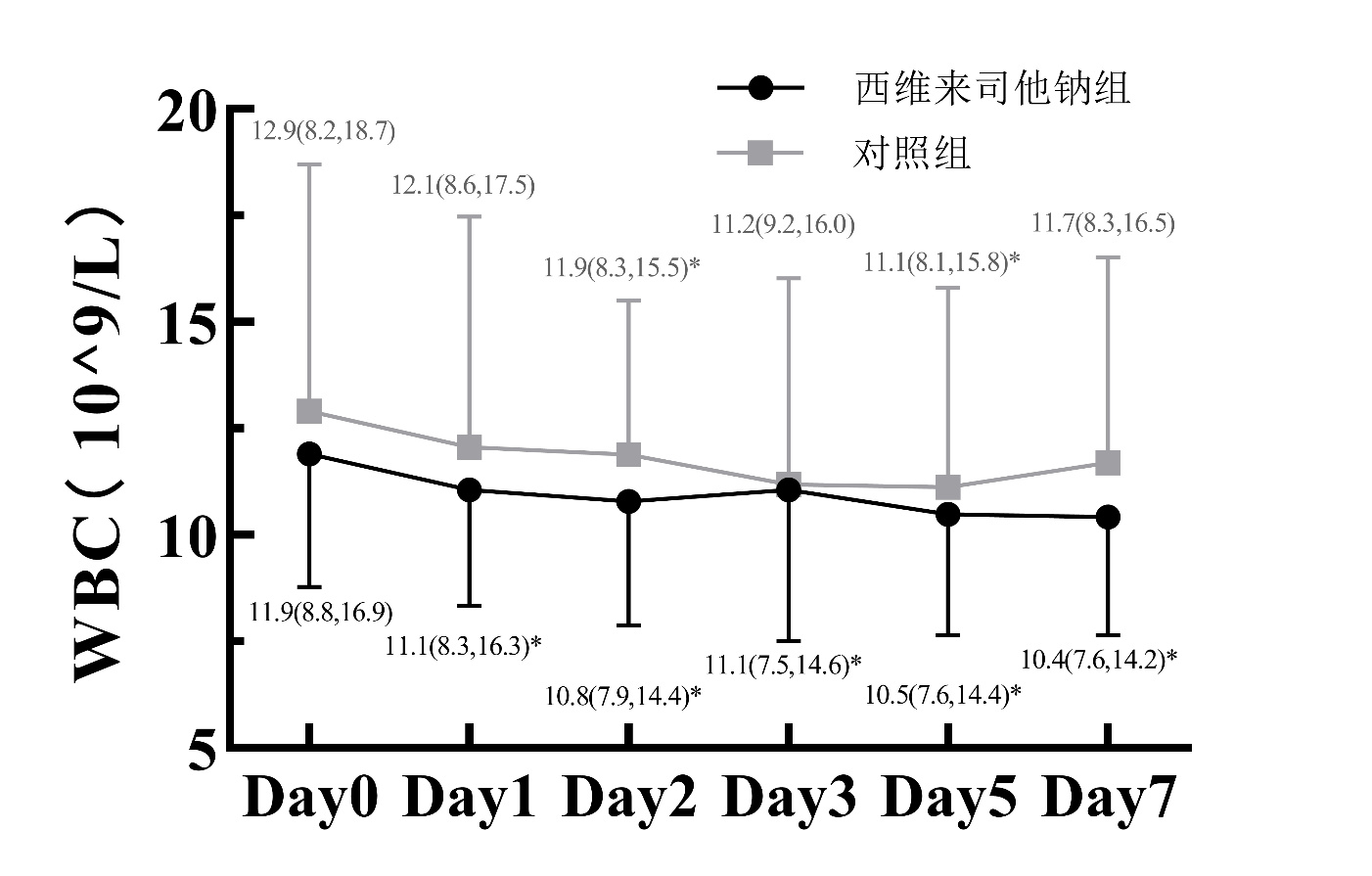
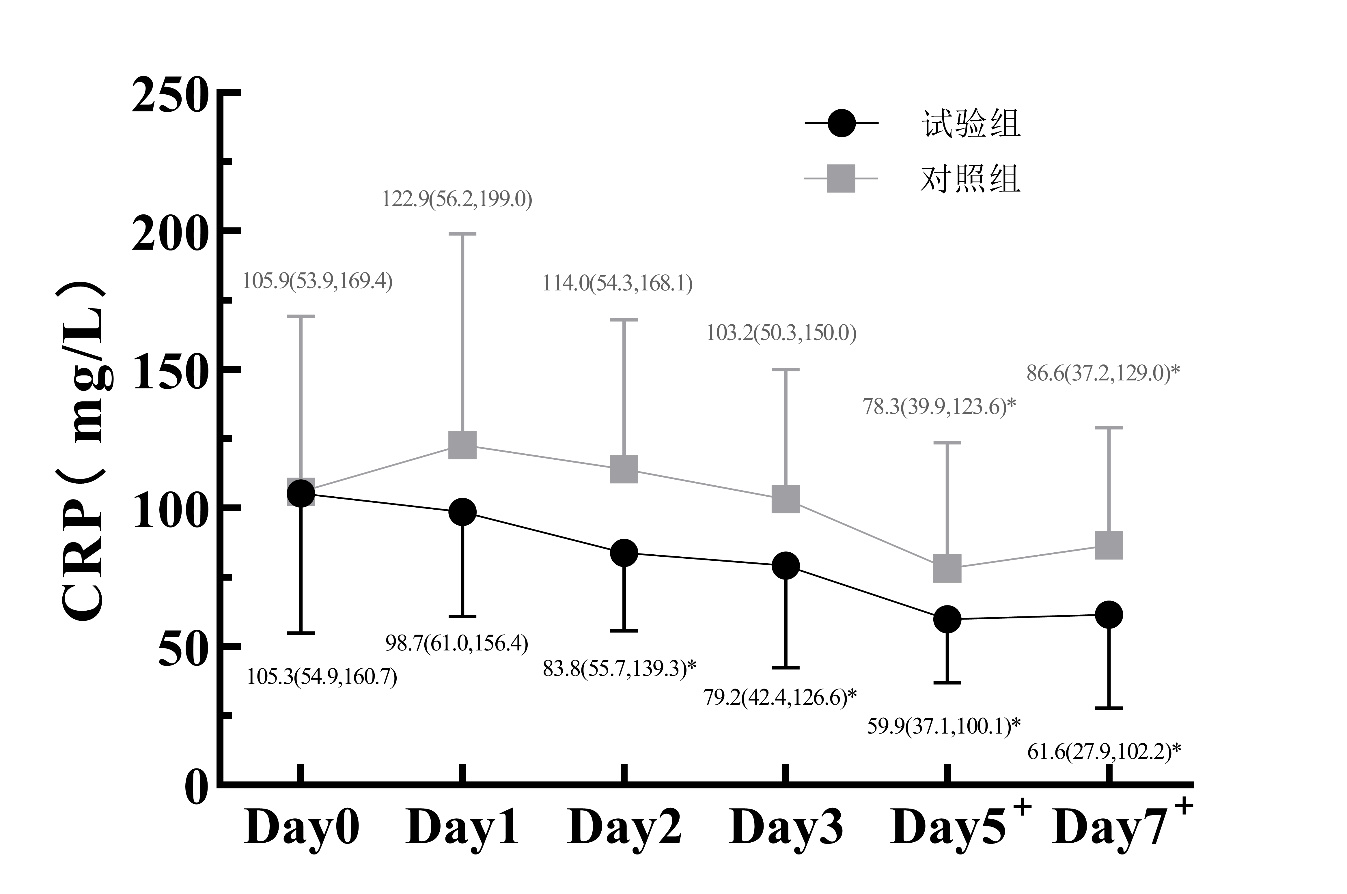
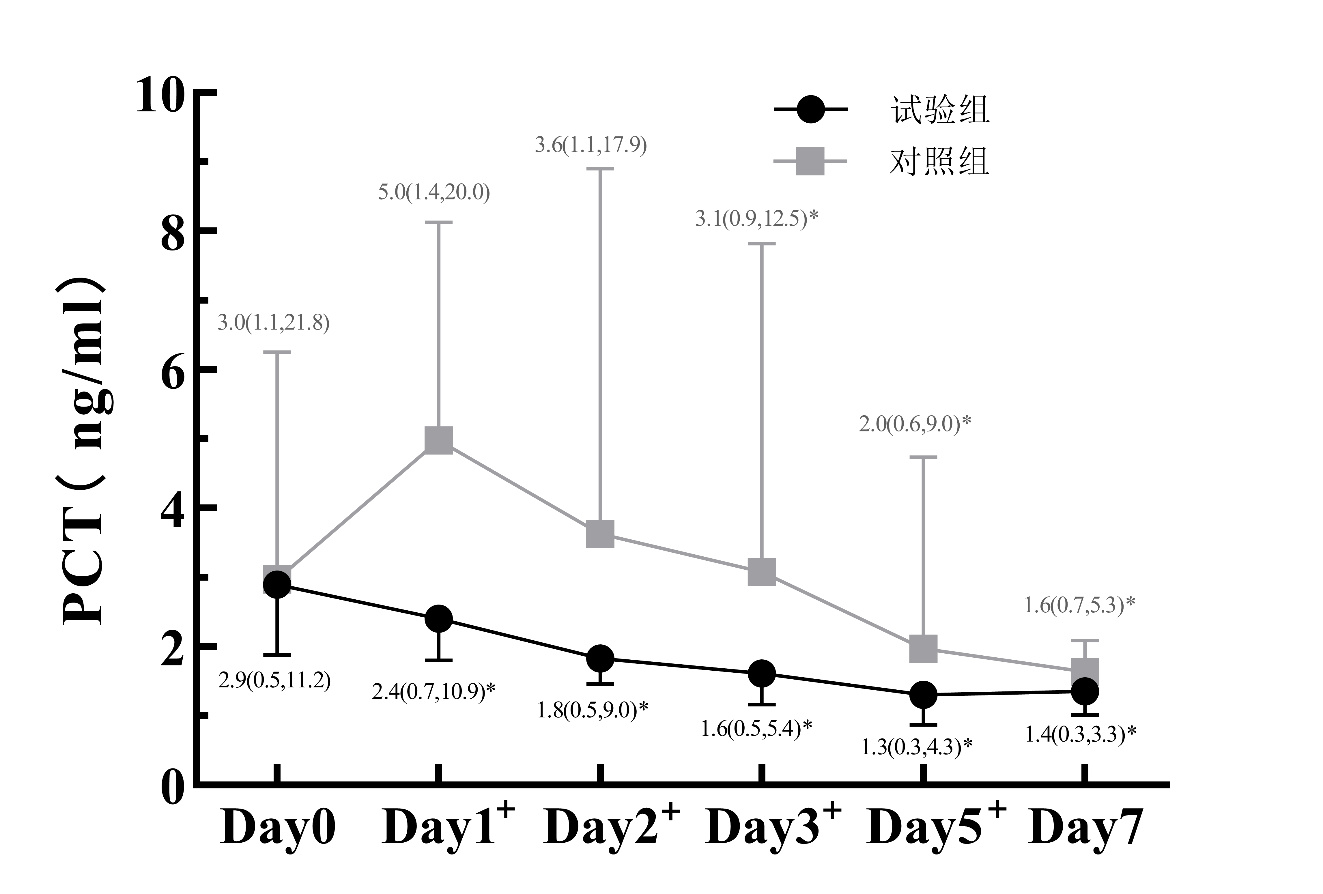
(2)图 4~6所示:7 d内两组WBC水平差异无统计学意义(Wald χ组别2=2.166,组别P=0.141),试验组CRP在D5和D7时较对照组显著降低(D5:Z=-2.250,P=0.024;D7:Z= -2.383,P=0.017),试验组PCT从D1到D5均较对照组显著降低(D1:Z=-2.744,P=0.006;D2:Z=-2.973,P=0.003;D3:Z=-2.603,P=0.009;D5:Z=-2.128,P=0.033)。同时,试验组WBC、CRP和PCT均较对照组更早降低。
|
| 注:与本组D0比较,aP<0.05 图 4 两组患者治疗7 d内WBC变化 |
|
|
|
| 注:两组间比较,aP<0.05;与本组D0比较,bP<0.05 图 5 两组患者治疗7 d内CRP变化 |
|
|
|
| 注:两组间比较,aP<0.05;与本组D0比较,bP<0.05 图 6 两组患者治疗7 d内PCT变化 |
|
|
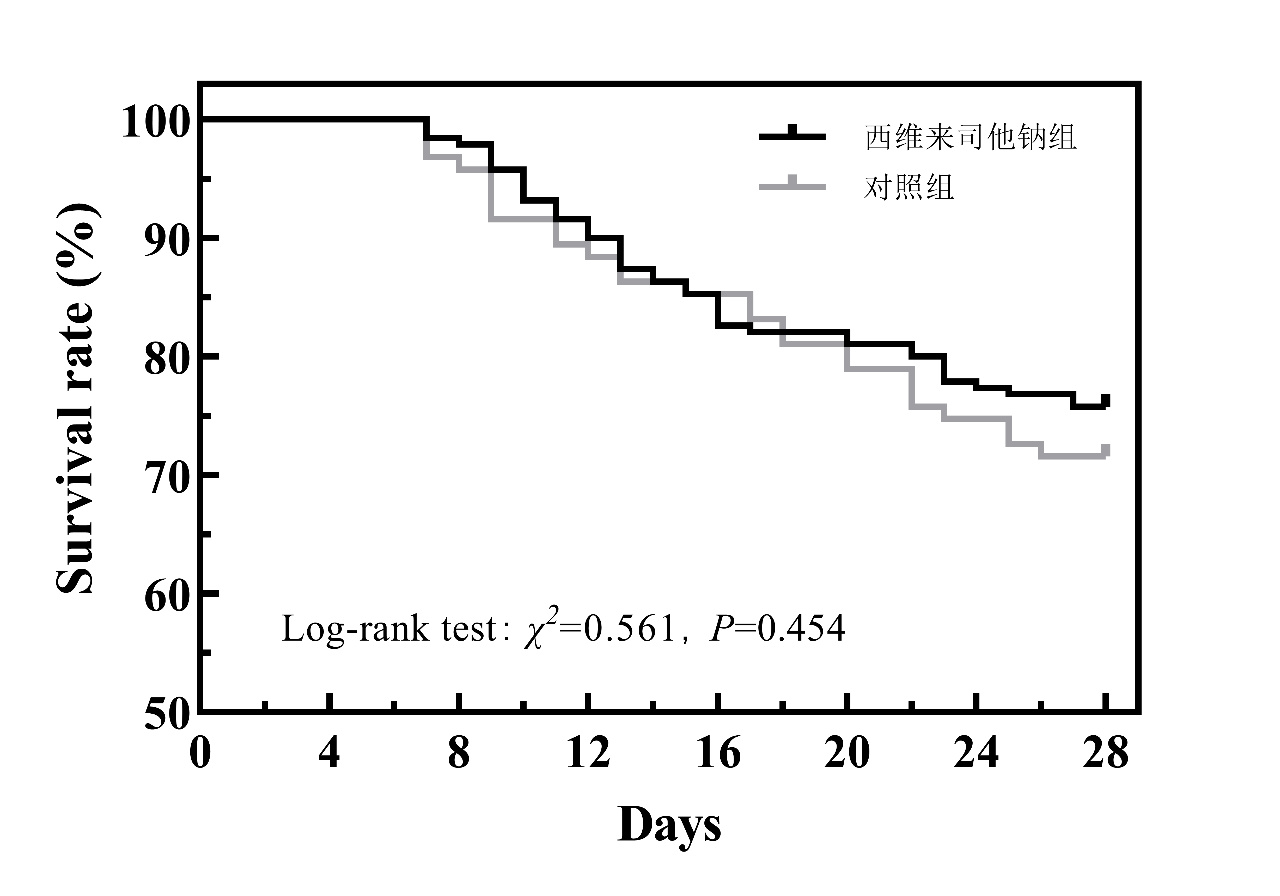
(3)表 2及图 7所示:试验组机械通气时间显著低于对照组,两组患者ICU住院时间及28 d病死率差异无统计学意义。
| 分组 | 机械通气时间(h,x±s) | ICU住院时间[d, M(Q1, Q3)] |
| 试验组(n=190) | 234.3±133.9 | 13.0(9.0,20.0) |
| 对照组(n=95) | 275.9±136.6 | 14.0(10.0,19.0) |
| t/Z值 | 2.455 | -0.001 |
| P值 | 0.015 | 0.999 |
|
| 图 7 两组28 d Kaplan-Meier生存曲线 |
|
|
本研究发现,西维来司他钠可改善脓毒症相关ARDS患者的氧合指数,缩短机械通气时间,降低SOFA评分和感染指标水平,但未能降低ICU住院时间及28 d病死率。
西维来司他钠主要应用于ALI/ARDS的治疗[14],在两项大型针对伴有SIRS的ALI/ARDS患者的临床研究中,西维来司他钠治疗显示了不同的临床结果。日本Ⅲ期研究显示,西维来司他钠组患者脱离机械通气中位时间较对照组缩短8 d,ICU中位住院时间较对照组缩短2.5 d(均P < 0.05),提示患者肺功能的改善可能受到西维来司他钠的影响[15];而STRIVE研究则显示西维来司他钠组和对照组脱离机械通气中位时间分别为6.9 d和7.6 d(P≥0.460)[16]。进一步分析发现,脓毒症患者占比可能导致了两项研究结果的差异,前者纳入人群患有脓毒症的比例明显高于后者(P=0.009)[17]。另有Miyoshi等[18]研究表明,在脓毒症相关ALI患者中,西维来司他钠的应用显著延长了患者的生存时间,但在无脓毒症的ALI患者中未观察到此疗效。本研究发现西维来司他钠的应用改善了脓毒症相关ARDS患者的氧合状态,降低了SOFA评分,缩短了机械通气时间,因此,脓毒症相关ARDS患者可能在西维来司他钠的治疗中获益更大。日本一项针对SIRS相关ALI患者的研究发现,西维来司他钠组的180 d生存率较对照组明显升高(调整混杂因素后)[19],目前为止规模最大的回顾性研究发现其在90 d生存率方面具有优势[20]。然而,本研究未观察到西维来司他钠在降低28 d病死率方面的优势。笔者认为,入住ICU的脓毒症相关ARDS患者,大部分已经接受了较长时间的治疗,西维来司他钠的给药时机或许已经错过了中性粒细胞主导的早期炎症反应阶段。考虑到脓毒症患者致病菌不同、感染部位不同,且病情复杂、多脏器受累,具有较大的异质性,单一一种药物实现生存率的显著提升是极具挑战性的。然而,研究表明,氧合指数的改善和机械通气时间的缩短,在整体上降低了患者的医疗支出,具有较高的花费收益比。
本研究为队列研究,混杂因素较多,本团队已着手设计更大范围的试验性研究,进一步明确选择性NE抑制剂在脓毒症相关ARDS治疗中的价值。其次,本研究为非随机、多中心临床试验,研究方案及治疗方案的统一培训并不能完全消除各医疗机构之间的差异对研究结果的影响。因此,鉴于研究方案的限制,对结果的解释需谨慎。
致谢: 感谢参研单位河南省胸科医院、河南中医药大学第一附属医院、郑州市中心医院、郑州人民医院、河南科技大学第一附属医院、平煤神马医疗集团总医院、安阳市人民医院、焦煤中央医院、濮阳市人民医院、驻马店中心医院全体医护人员的奉献
利益冲突 所有作者均声明无利益冲突
作者贡献声明 孙同文:试验设计、研究指导、论文审阅;刘韶华、祁雪颜:数据收集和统计分析、文章撰写;丁显飞、张晓娟、王海旭、段晓光、兰超、朱志强、王勇、邢丽华、冯敏、苗旺、邓文静、张保全、周东民、祁绍艳、张长玉:入组患者、数据收集与处理
| [1] | 中国研究型医院学会危重医学专委会, 宁波诺丁汉大学GRADE中心. 中国成人急性呼吸窘迫综合征(ARDS)诊断与非机械通气治疗指南(2023)[J]. 中华急诊医学杂志, 2023, 32(10): 1304-1318. DOI:10.3760/cma.j.issn.1671-0282.2023.10.004 |
| [2] | 杜欣欣, 潘鹏飞, 于湘友. 急性呼吸窘迫综合征的定义: 昨天, 今天, 明天[J]. 中华急诊医学杂志, 2023, 32(8): 1023-1027. DOI:10.3760/cma.j.issn.1671-0282.2023.08.003 |
| [3] | Kumar V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury[J]. Front Immunol, 2020, 11: 1722. DOI:10.3389/fimmu.2020.01722 |
| [4] | 王雪, 李晶菁, 黄中伟. 中性粒细胞外陷阱在脓毒症发生机制中的研究进展[J]. 中华急诊医学杂志, 2023, 32(6): 837-840. DOI:10.3760/cma.j.issn.1671-0282.2023.06.025 |
| [5] | Englert JA, Bobba C, Baron RM. Integrating molecular pathogenesis and clinical translation in sepsis-induced acute respiratory distress syndrome[J]. JCI Insight, 2019, 4(2): e124061. DOI:10.1172/jci.insight.124061 |
| [6] | Sun YL, Ding XF, Cui YQ, et al. Positive effects of neutrophil elastase inhibitor (sivelestat) on gut microbiome and metabolite profiles of septic rats[J]. Front Cell Infect Microbiol, 2022, 12: 818391. DOI:10.3389/fcimb.2022.818391 |
| [7] | 谷玉雷, 肖莉丽, 裴辉, 等. 西维来司他钠在重症监护室急性肺损伤患者中应用的有效性和安全性研究[J]. 中华急诊医学杂志, 2022, 31(8): 1061-1065. DOI:10.3760/cma.j.issn.1671-0282.2022,08.008 |
| [8] | 祁雪颜, 丁显飞, 原阳阳, 等. 西维来司他钠治疗脓毒症患者的有效性和安全性研究[J]. 中华危重病急救医学, 2023, 35(1): 51-55. DOI:10.3760/cma.j.cn121430-20220531-00519 |
| [9] | Ding QL, Wang Y, Yang CB, et al. Clinical utility of the sivelestat for the treatment of ALI/ARDS: moving on in the controversy?[J]. Intensive Care Res, 2023, 3(1): 12-17. DOI:10.1007/s44231-022-00012-5 |
| [10] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801. DOI:10.1001/jama.2016.0287 |
| [11] | Ranieri VM., Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [12] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [13] | Brower RG, Matthay MA, Morris A, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome[J]. N Engl J Med, 2000, 342(18): 1301-1308. DOI:10.1056/nejm200005043421801 |
| [14] | 中国研究型医院学会危重医学专业委员会, 中国医药教育协会重症医学专业委员会. 西维来司他钠临床应用专家共识[J]. 中国研究型医院, 2022, 9(1): 9-13. DOI:10.19450/j.cnki.jcrh.2022.01.003 |
| [15] | Tamakuma S, Ogawa M, Aikawa N, et al. Relationship between neutrophil elastase and acute lung injury in humans[J]. Pulm Pharmacol Ther, 2004, 17(5): 271-279. DOI:10.1016/j.pupt.2004.05.003 |
| [16] | Zeiher BG, Artigas A, Vincent JL, et al. Neutrophil elastase inhibition in acute lung injury: Results of the STRIVE study[J]. Crit Care Med, 2004, 32(8): 1695-1702. DOI:10.1097/01.ccm.0000133332.48386.85 |
| [17] | Hayakawa M, Katabami K, Wada T, et al. Sivelestat (selective neutrophil elastase inhibitor) improves the mortality rate of sepsis associated with both acute respiratory distress syndrome and disseminated intravascular coagulation patients[J]. Shock, 2010, 33(1): 14-18. DOI:10.1097/shk.0b013e3181aa95c4 |
| [18] | Miyoshi S, Ito R, Katayama H, et al. Combination therapy with sivelestat and recombinant human soluble thrombomodulin for ARDS and DIC patients[J]. Drug Des Devel Ther, 2014, 8: 1211-1219. DOI:10.2147/DDDT.S68030 |
| [19] | Aikawa N, Ishizaka A, Hirasawa H, et al. Reevaluation of the efficacy and safety of the neutrophil elastase inhibitor, Sivelestat, for the treatment of acute lung injury associated with systemic inflammatory response syndrome; a phase Ⅳ study[J]. Pulm Pharmacol Ther, 2011, 24(5): 549-554. DOI:10.1016/j.pupt.2011.03.001 |
| [20] | Kido T, Muramatsu K, Yatera K, et al. Efficacy of early sivelestat administration on acute lung injury and acute respiratory distress syndrome[J]. Respirology, 2017, 22(4): 708-713. DOI:10.1111/resp.12969 |
 2025, Vol. 34
2025, Vol. 34