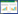2. 郑州大学第一附属医院体外支持中心,郑州 450046
2. Extracorporeal Life Support Center, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450046, China
心脏骤停(cardiac arrest, CA)是全球重大公共卫生挑战之一。根据国际复苏联络委员会(ILCOR)2023年报告,全球院外心脏骤停(out-of-hospital cardiac arrest, OHCA)的年发病率为(40.8~100.2)/10万,但生存率仅1.8%~11.0%[1]。我国BASIC-OHCA登记研究显示,OHCA患者的自主循环恢复(restoration of spontaneous circulation, ROSC)率、出院存活率和良好神经功能预后(脑功能表现分级CPC 1~2级)分别仅为5.98%、1.15%和0.83%[2],显著低于发达国家水平。
体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)为难治性OHCA提供了新希望。通过快速建立静脉-动脉体外膜肺氧合(VA-ECMO),ECPR能在心肺复苏期间提供更多的循环血量维持器官灌注,其核心优势在于:突破传统CPR(conventional CPR, CCPR)的流量限制;为冠状动脉和脑组织提供氧合血[3]。国际研究证实,ECPR可将OHCA患者的良好神经功能预后提升至14%~21%[4-6],但不同中心差异较大[7],提示技术标准化亟待完善。
尽管OHCA-ECPR适应症的选择(比如:初始可除颤心率)和ECPR患者的ICU监测管理(比如:平均动脉压(mean arterial pressure, MAP)≥65 mmHg, 1 mmHg=0.133 kPa)已被广泛探讨[8-9]。而ECMO启动至ICU转入期间的血流动力学监测标准仍属空白,此阶段为机体缺血-再灌注的早期阶段。本研究将早期建立有创动脉血压监测和处理作为一种干预措施,通过对本院44例抢救室ECPR患者进行回顾,对比分析患者出院生存率及出院脑功能评分的差异,为OHCA-ECPR的合理应用提供参考。
1 资料与方法 1.1 研究对象本研究为单中心回顾性队列研究,连续纳入2021年1月至2023年1月郑州大学第一附属医院急诊抢救室收治的OHCA并行ECPR的成年患者。所有患者家属均签署ECPR知情同意书。所有患者需满足以下纳入标准:(1) 年龄18~70岁;(2) 心脏骤停时有目击者且接受旁观者心肺复苏,无血流时间 < 5 min;(3) 持续传统心肺复苏(CCPR) > 15 min未恢复ROSC,或ROSC后出现血流动力学不稳定/反复CA;(4) CA至入院时间 < 30 min且预计至ECMO转流成功时间 < 60 min;(4) 临床判断病因可逆(如心源性、肺栓塞等);(5) ECMO置管前动脉血乳酸 < 18 mmol/L。排除标准:(1)存在不可逆性脑损伤(大面积脑梗死/出血);(2)终末期疾病(肿瘤晚期、多器官衰竭);(3)活动性大出血(创伤性、消化道或颅内);(4)患者/家属明确拒绝积极治疗;(5)心脏超声证实严重主动脉瓣反流(反流面积 > 5 cm2)。本研究经郑州大学第一附属医院科研和临床试验伦理委员会批准(批准文号:2024-KY-2087),豁免知情同意。患者纳入流程图见图 1。
|
| 图 1 纳入患者流程图 Fig 1 Flowchart of included patients |
|
|
根据有创动脉血压监测(invasive arterial blood pressure, IBP)建立时机分为:早期干预组(n=23):ECMO流量稳定(≥3 L/min)后3 min内,于超声引导下完成对侧股动脉IBP建立;晚期干预组(n=21):按常规流程转入ICU后建立IBP,中位延迟时间71(60, 80) min。
本研究患者IBP建立位置:ECMO置管的对侧肢体股动脉(中心动脉)。相较于常规的桡动脉动脉血压监测,ECPR患者进行对侧肢体股动脉(中心动脉)进行有创动脉血压具有更加快速,及时,可操作性等特点,ECPR同期即可获得相关数据从而更早进行干预。
关于选择IBP理由,因为相关研究已经证实:对于危重患者,IBP和袖套法的无创血压存在巨大差异[10],无创血压的准确性受到多项研究质疑[11]。中心有创血压可以更准确反应患者真实血压,相对无创血压监测可以减少对低血压的误判,两者差值-1.0 mmHg(±10.2 mmHg,-21.0~18.9 mmHg)[12]。同时实际临床工作中,ECPR早期心脏经常要经历无电活动,无脉电活动,室速,室颤等阶段,基于CA时的病理生理特点,如心脏泵血功能严重受损、外周循环灌注不足等,美国心脏协会(American Heart Association, AHA)建议使用IBP监测复苏工作[13]。
1.3 ECPR实施流程急救人员(emergency medical services, EMS)到达前由目击者在急救医生电话指导下CPR,EMS到达后由医护人员进行高级生命支持,同时将患者转运至急救中心抢救室,同时电话呼叫ECMO团队进行ECPR适应证的评估、家属谈话签字及ECMO上机前准备(包括超声准备、穿刺备鞘、ECMO设备准备及管道预充等)。ECPR置管流程:消毒,铺巾,选取同侧或双侧股动静脉为穿刺点,采用采用改良的Seldinger技术,超声引导下行股动静脉经皮穿刺插管。ECMO机器使用德国MAQUET公司的PLS系统(Rotaflow离心泵、PLS套包),插管管路使用Bio-Medicus插管。ECMO模式均为V-A模式。设置初始流速为3.0~4.0 L/min。
1.4 血压监测建立与干预早期干预组:ECMO转流后2 min内超声引导下在对侧股动脉完成血压穿刺置管和监测,目标血压:MAP≥65或收缩压(systolic pressure, SBP)≥90 mmHg。具体血压调整及患者一般管理,如容量管理,内环境纠正,必要时血管活性药物应用,抗凝,抗感染等均按照按国内及国际复苏联盟等指南进行[14-16]。
晚期血压监测及干预:ECMO转流后,根据临床需要决定是否建立下肢分流,管道消毒固定,CT等影像检查,冠脉照影必要时冠脉介入治疗,转科入ICU后再建立有创动脉血压监测。目标血压:MAP≥65 mmHg或SBP≥90 mmHg。余同早期干预组。
1.5 观察指标主要指标:出院存活率,出院脑功能评分(cerebral performance category, CPC)。次要指标:入ICU时复苏后休克率,24 h内循环崩溃率,6个月患者存活率,6个月CPC。
复苏后休克:尽管有足够的液体负荷,但在ROSC后MAP < 60 mmHg或收缩压低于90 mmHg,并且需要输注去甲肾上腺素或肾上腺素等血管活性药物应用[17]。
循环崩溃:容量负荷充足,极量血管活性药物应用下MAP < 60 mmHg,脏器功能持续恶化,或心搏无法维持,无继续治疗价值。
1.6 统计学方法本研究采用SPSS 25.0进行统计分析。计量资料经Shapiro-Wilk检验确认正态性,符合正态分布者以均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布者以中位数(四分位数)[M(Q1, Q3)]表示,采用Mann-Whitney U检验。计数资料以例数(百分比)表示,根据样本量及理论频数选择卡方检验或Fisher确切概率法进行组间比较。采用Spearman相关分析评估有序变量间的相关性。多因素分析采用Logistic回归(向前逐步法),校正年龄、初始心律和乳酸水平等混杂因素,计算调整比值比(aOR)及其95%置信区间(CI)。
为验证基线差异(如pH值)对结果的潜在影响,在多因素回归模型校正基础上,进一步按pH值中位数分层分析,并计算校正后OR值的95%置信区间一致性。所有统计检验均为双侧检验,P < 0.05认为差异具有统计学意义。
2 结果 2.1 患者筛选与基线资料研究期间共357例OHCA患者就诊,53例接受ECPR治疗,排除不符合标准的9例(脑梗或脑出血1例;原发器官功能终末期2例;无法控制的出血2例;拒绝继续治疗4例,最终符合研究制定的纳入和排除标准的ECPR患者44例(12.3%),这与相关研究结果一致:OHCA中符合ECPR标准的仅约10%[18]。早期干预组出院存活率(43.5% vs. 9.5%)及良好神经功能预后(CPC 1~2级:34.8% vs. 9.5%)显著优于晚期干预组(均P < 0.05)。两组基线资料除体重[(74.0±8.1) kg vs. (67.5±12.0) kg, P=0.04]外,均差异无统计学意义,见表 1。
| 项目 | 早期干预组(n=23) | 晚期干预组(n=21) | t/χ2/U值 | P值 |
| 人口学特征 | ||||
| 男性a | 17 (73.9%) | 16 (76.2) | 0.03 | 0.862 |
| 年龄(岁) b | 56.0 (48.5, 65.5) | 56.0 (47.0, 69.0) | 240.50 | 0.981 |
| 身高(cm) c | 168.0±6.4 | 167.0±5.8 | 0.78 | 0.442 |
| 体重(kg) c | 74.0±8.1 | 67.5±12.0 | 2.15 | 0.041 |
| BMI(kg/m2) c | 26.1±3.0 | 24.1±3.8 | 1.92 | 0.061 |
| 既往史a | ||||
| 糖尿病 | 4 (17.4) | 8 (38.1) | 2.37 | 0.124 |
| 高血压 | 9 (39.1) | 10 (47.6) | 0.32 | 0.570 |
| 心脏病 | 13 (56.5) | 13 (61.9) | 0.13 | 0.717 |
| 个人史a | ||||
| 心脏介入史 | 3 (13.6) | 6 (28.6) | 1.45 | 0.229 |
| 吸烟 | 12 (52.2) | 10 (47.6) | 0.09 | 0.763 |
| 酗酒 | 10 (43.5) | 9 (42.9) | 0.00 | 0.967 |
| 心梗导致CA | 16 (69.6) | 15 (71.4) | 0.02 | 0.892 |
| 注:a为(n, %),b为M(Q1, Q3),c为(x±s);BMI为身体质量指数,CA为心搏骤停 | ||||
两组在初始可电击心律(47.8% vs. 76.2%, P=0.05)、ECMO前pH值(7.1 vs. 6.9, P=0.03)差异有统计学意义。但ECMO操作时间、CA至ECMO流量稳定时间等关键指标差异无统计学意义(均P > 0.05)。值得注意的是,早期干预组ECPR后至入ICU时间显著长于晚期组(140 min vs. 71 min, P < 0.001),见表 2。
| 项目 | 早期干预组(n=23) | 晚期干预组(n=21) | t/χ2/U值 | P值 |
| ECMO上机前 | ||||
| 上机前pH a | 7.1 (6.8, 7.2) | 6.9 (6.85, 7.0) | 150.00 | 0.031 |
| 上机前LAC(mmol/L) a | 14.0 (10.1, 20.0) | 15.0 (12.8, 15) | 232.50 | 0.832 |
| 初始可电击心率b | 11 (47.8%) | 16 (76.2%) | 3.73 | 0.023 |
| 旁观者CPR b | 20 (87.0%) | 17 (81.0%) | 0.29 | 0.587 |
| ECPR前ROSC b | 5 (21.7%) | 2 (9.5%) | – | 0.246 |
| CA至ECMO启动时间(min) a | 30 (15, 42) | 32 (21, 48.5) | 211.50 | 0.481 |
| ECPR过程中 | ||||
| ECMO操作时间(min) a | 13 (10, 17) | 13 (10, 29) | 236.00 | 0.895 |
| CA至ECMO运行且流量稳定时间(min) a | 41 (31, 57) | 42 (38, 62.5) | 216.00 | 0.549 |
| ECPR后ROSC b | 19 (82.6) | 18 (85.7) | – | 0.553 |
| 联合治疗b | ||||
| CAG必要时PCI | 15 (78.9) | 14 (70.0) | – | 0.394 |
| IABP | 4 (17.4) | 2 (9.5) | – | 0.378 |
| CRRT | 3 (13) | 3 (14.3) | – | 0.622 |
| 住院时间(d)a | ||||
| ECMO运行时间(h) | 33 (6, 72) | 9.5 (4, 380) | 1.14 | 0.183 |
| ECPR后至入ICU时间(min) | 140 (105, 190) | 71 (60, 80) | 34.50 | < 0.001 |
| 住院时间(d) | 3 (1, 19) | 1 (1, 2) | 1.66 | 0.078 |
| 注:a为M(Q1, Q3),b为(n, %);pH为酸碱度,LAC为乳酸,CAG为冠状动脉造影术,PCI为经皮冠状动脉介入治疗,ROSC为自主循环恢复,IABP为主动脉内球囊反搏,CRRT为连续肾脏替代治疗 | ||||
早期干预组入ICU时休克率显著更低(39.1% vs. 80.0%, P=0.007),但24 h内循环崩溃率无差异(39.1% vs. 60.0%, P=0.172),见表 3,两组共21/44(47.7%)的患者出现24 h内循环崩溃而死亡或放弃治疗。
| 指标 | 早期干预组(n=23) | 晚期干预组(n=21) | χ2值 | P值 |
| 入ICU时复苏后休克率 | 9(39.1) | 16(80.0) | 7.34 | 0.007 |
| 24 h内循环崩溃率 | 9(39.1) | 12(60.0) | 1.87 | 0.172 |
| 出院存活率 | 10(43.5) | 2(9.5) | Fisher | 0.012 |
| 出院脑功能良好(CPC 1~2) | 8(34.8) | 2(9.5) | 3.99 | 0.044 |
| 6个月存活率 | 8(34.8) | 2(9.5) | 3.99 | 0.04 |
| 6个月脑功能良好(CPC 1~2) | 8(34.8) | 2(9.5) | 3.99 | 0.04 |
| 注:CPC为脑功能分类评分,ICU为重症监护病房 | ||||
早期干预组出院存活率(43.5% vs. 9.5%, OR=7.31, 95%CI: 1.37~38.97)及出院CPC 1~2级比例(34.8% vs. 9.5%)均显著更高(均P < 0.05)。模型调整后,多因素分析显示早期干预(aOR=18.84, 95%CI: 1.97~179.98)和初始可电击心律(aOR=16.76, 95%CI: 1.04~269.57)是生存的独立预测因素。分层分析中,pH > 7.0亚组aOR=0.392, (0.106~0.678),pH≤7.0亚组aOR=0.385(0.075~0.695),见表 4。为验证早期干预效果是否受基线酸中毒影响,按pH值中位数(7.0)分层分析显示,在pH > 7.0亚组中早期干预与生存显著相关(aOR=0.392, 95%CI: 0.106~0.678, P=0.008),pH≤7.0亚组仍存在获益趋势(aOR=0.385, 95%CI: 0.075~0.695, P=0.019;交互作用不显著P=0.183)。两组患者6个月的生存率和脑功能评分与出院时一致。
| 项目 | 未调整OR | 调整OR | |||||||
| OR | 95%CI | P值 | OR | 95%CI | P值 | ||||
| 下限 | 上限 | 下限 | 上限 | ||||||
| 早期血压监测及干预 | 7.31 | 1.37 | 38.97 | 0.020 | 18.84 | 1.97 | 179.98 | 0.011 | |
| 初始可电击心律 | 2.05 | 0.47 | 0.06 | 0.343 | 16.76 | 1.04 | 269.57 | 0.047 | |
| CA-ECMO运行且流量稳定时间(min) | 1.00 | 0.97 | 1.03 | 0.950 | |||||
| 上机前pH | 26.63 | 1.21 | 585.31 | 0.037 | 3.36 | 0.06 | 187.76 | 0.556 | |
| 上机前乳酸(mmol/L) | 0.90 | 0.79 | 1.03 | 0.124 | |||||
| 体重(kg) | 1.02 | 0.96 | 1.09 | 0.647 | |||||
| 注:CA为心搏骤停,ECMO为体外膜肺氧合,OR为比值比,CI为置信区间 | |||||||||
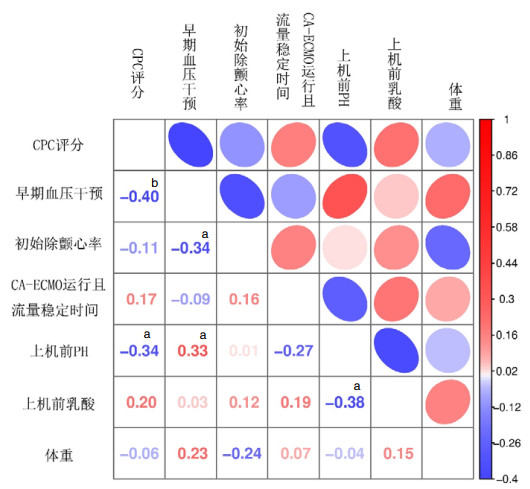
CPC评分为等级资料,采用Spearman等级资料的相关性检验,Spearman检验显示,CPC评分与早期干预(ρ=0.40, P=0.007)及上机前pH(ρ=0.34, P=0.026),CPC评分和上机前pH之间有相关关系,但其相关性较与早期血压干预的相关性弱(0.34 < 0.40),见图 2。
|
| 注:数据为相关系数(ρ),a表示P < 0.05, b表示P < 0.05;早期血压干预(ρ=-0.40, P=0.007)和上机前pH值(ρ=-0.34, P=0.026)与CPC评分呈显著负相关 图 2 ECPR患者CPC评分与临床指标的相关性分析(Spearman法) Fig 2 Correlation analysis between CPC score and clinical indicators in ECPR patients (Spearman's test) |
|
|
本研究通过单中心回顾性分析证实,OHCA-ECPR患者在ECMO启动后早期建立有创血压监测并干预,可显著提升出院存活率(43.5% vs. 9.5%)和良好神经功能预后(CPC 1~2级:34.8% vs. 9.5%)。这一结果为OHCA-ECPR患者的精细管理提供了新的循证依据。
本研究明确了ECPR后早期血压管理的重要性。与以往那些关注心肺复苏过程中的血压管理的研究是一致的,这些研究发现患者CPR期间IBP测量以及维持一定压力与患者ROSC和更高的出院存活率相关[19-20]。然而,对于ECPR患者,以前的研究没有证明OHCA-ECPR早期血压管理与预后的关系。IBP监测模块在国内抢救室可能不是常规配制,同时对于ECPR患者,医务人员更关注的是ECPR操作,团队配合,ECPR相关时间节点等[21],可以尽快通过ECMO恢复患者循环的因素,因为众多研究已表明缩短低流量时间,尽早恢复全身循环与患者良好结局密切相关[22]。ECMO替代了心脏泵血,增加了全身灌注,但血压的维持是一个综合的管理过程。本研究参照相关指南通过容量管理,血管活性药物应用等手段维持MAP≥65 mmHg。值得注意的是,即使在严重酸中毒(pH≤7.0)的患者中,早期血压监测仍显示出生存获益趋势(aOR=0.385),且与轻度酸中毒组(pH > 7.0)的疗效无交互作用(P=0.183),即pH的高低对本研究主要结局指标无影响。包括大脑在内的多器官都是压力灌注型器官,持续处于休克状态,器官功能或许很难改善。鉴于以上,本研究的结果支持将IBP测量及必要时干预作为OHCA-ECPR复苏过程过的参考指标。
CA后综合征和CA缺氧性脑损伤是一个复杂的反应过程,涉及初始缺氧损伤、再灌注损伤、随后的氧化反应和凋亡反应之间的相互作用与患者的不良结局相关[23-24]。而关于平均动脉压(MAP),脑灌注压(CePP),冠脉灌注压(CPP)的研究很多都是基于患者ROSC或者进入ICU后的目标血压管理[25-26]。上文已经指出有少量研究已经关注到CA过程中血压管理对于CA患者的ROSC,出院生存率和良好神经系统预后相关。对于ECPR患者ECMO操作完成只是心肺脑复苏中的其中一步,绝大多数患者ECMO运行到ROSC仍需要一定时间,ECPR后通常还会经历CT检查,多学科会诊,CAG必要时PCI,转科,转运等之后才会进入ICU。本研究ECPR后至进入ICU时间中位时间为102.5(70, 146) min。这段时间或长或短可称为ROSC早期,是CA后继发性脑损伤发生发展的关键时间,可能伴随的病理生理改变包括大脑自动调节功能丧失[27],脑水肿,低血压,高乳酸,高氧/低氧,氧自由基形成等[5]。本研究提示晚期干预组在早期缺乏对动脉血压监测及干预,入ICU时复苏后休克率高达80%。复苏后休克:尽管有足够的液体负荷,但在ROSC后MAP低于60 mmHg或收缩压低于90 mmHg,并持续一定时间。相关研究已经证实,复苏后休克与患者大脑损伤及苏醒延迟有密切相关[28]。同时有研究表明,入ICU 1 h内收缩动脉血压 < 90 mmHg与较高的院内病死率独立相关[29]。所以ROSC早期,进行动脉血压监测和MAP维持到水平至关重要。虽然最佳血压管理尚不清楚,但多项指南建议MAP至少 > 65 mmHg,以确保足够的脑灌注[30]。本研究提出的IBP监测时机从ECMO运行3 min以内开始至入ICU前的全过程,包含了ECPR—ROSC—检查—手术—MTD—院内转运—ICU,充分发挥了ECMO在CA患者救治中的“桥梁作用”[31],并且在IBP的准确监测下完成相关检查和治疗。
本研究发现,晚期干预的组,入ICU后,24 h内循环崩溃率高达60%,且与早期干预组的差异有统计学意义(P < 0.05)。人体处于休克状态会出现一系列复杂的病理生理变化,包括炎症因子释放,微循环自动调节机制受损,微循环血栓,组织细胞氧供失衡,细胞代谢紊乱等,进而影响各器官灌注[32]。尽早积极有效的的监测和纠正休克,可以减少进展到微循环衰竭期(难治期),DIC期和循环衰竭期。然这一观察指标非本研究的主要方向,未来有待更进一步的相关研究。
国内外多项研究已经表明,无论对于院内还是院外CA患者,按照指南等要求做好严格筛选,在经验丰富,流程完善,技术熟练的ECMO中心,ECPR的存活率明显好于CCPR[7, 33-34]。但是ECPR是一种高度侵入性、成本高昂且资源密集型的干预措施,因此很多研究都关注到了OHCA患者ECPR的成本效益问题[3, 35]。因此注重OHCA-ECPR管理中的各种细节(比如本研究的提出的早起血压干预),进一步提升ECPR患者生存率是ECPR技术推广和得到认可的关键。
综上所述,ECPR是挽救院外CA患者的有效手段。患者行ECPR后,在ROSC早期血压监测和干预可以进一步提高OHCA患者生存率和良好神经系统预后比例。但OHCA患者救治不应该仅重视ECPR技术本身,ROSC早期管理需要同样被重视,包括本研究提出的是早期血压监测和干预对OHCA患者结局产生有利影响。本研究更希望传递的是ECPR治疗后的早干预、早处理的理念。
本研究存在以下局限性,本研究为单中心、回顾性研究,样本量较小,可能会影响最终结论。本文缺乏长期随访结果,无法对存活组患者院外恢复情况进行进一步评估。期待未来有大型多中心、前瞻性研究来完善当前结论。
利益冲突 所有作者声明无利益冲突
作者贡献声明 宋晓东:研究设计与实施、资料收集整理、撰写论文并对文章整体负责;黄明君, 李军, 郭航, 罗垚, 陶晋, 张强, 胡悦朋, 贾新雅, 杨柳, 张唐娟, 窦冬青, 曹建良, 赵晖, 曹耿磊, 阚亚柏, 李杏杏:研究评估与实施、资料收集;李军:统计分析和论文修改;兰超:质量控制及审校
| [1] | Berdowski J, Berg RA, Tijssen JGP, et al. Global incidences of out-of-hospital cardiac arrest and survival rates: Systematic review of 67 prospective studies[J]. Resuscitation, 2010, 81(11): 1479-1487. DOI:10.1016/j.resuscitation.2010.08.006 |
| [2] | Xie X, Zheng JQ, Zheng W, et al. Efforts to improve survival outcomes of out-of-hospital cardiac arrest in China: basic-OHCA[J]. Circ Cardiovasc Qual Outcomes, 2023, 16(2): e008856. DOI:10.1161/CIRCOUTCOMES.121.008856 |
| [3] | Abrams D, MacLaren G, Lorusso R, et al. Extracorporeal cardiopulmonary resuscitation in adults: evidence and implications[J]. Intensive Care Med, 2022, 48(1): 1-15. DOI:10.1007/s00134-021-06514-y |
| [4] | Sakamoto T, Morimura N, Ken NG, et al. Extracorporeal cardiopulmonary resuscitation versus conventional cardiopulmonary resuscitation in adults with out-of-hospital cardiac arrest: a prospective observational study[J]. Resuscitation, 2014, 85(6): 762-768. DOI:10.1016/j.resuscitation.2014.01.031 |
| [5] | Inoue A, Hifumi T, Sakamoto T, et al. Extracorporeal cardiopulmonary resuscitation for out-of-hospital cardiac arrest in adult patients[J]. J Am Heart Assoc, 2020, 9(7): e015291. DOI:10.1161/JAHA.119.015291 |
| [6] | Patricio D, Peluso L, Brasseur A, et al. Comparison of extracorporeal and conventional cardiopulmonary resuscitation: a retrospective propensity score matched study[J]. Crit Care, 2019, 23(1): 27. DOI:10.1186/s13054-019-2320-1 |
| [7] | Scquizzato T, Bonaccorso A, Consonni M, et al. Extracorporeal cardiopulmonary resuscitation for out-of-hospital cardiac arrest: a systematic review and meta-analysis of randomized and propensity score-matched studies[J]. Artif Organs, 2022, 46(5): 755-762. DOI:10.1111/aor.14205 |
| [8] | Pagura L, Fabris E, Rakar S, et al. Does extracorporeal cardiopulmonary resuscitation improve survival with favorable neurological outcome in out-of-hospital cardiac arrest? A systematic review and meta-analysis[J]. J Crit Care, 2024, 84: 154882. DOI:10.1016/j.jcrc.2024.154882 |
| [9] | Lim SL, Low CJW, Ling RR, et al. Blood pressure targets for out-of-hospital cardiac arrest: a systematic review and meta-analysis[J]. J Clin Med, 2023, 12(13): 4497. DOI:10.3390/jcm12134497 |
| [10] | Markakis K, Pagonas N, Georgianou E, et al. Feasibility of non-invasive measurement of central blood pressure and arterial stiffness in shock[J]. Eur J Clin Invest, 2021, 51(9): e13587. DOI:10.1111/eci.13587 |
| [11] | Kumar S, Yadav S, Kumar A. Accuracy of oscillometric-based blood pressure monitoring devices: impact of pulse volume, arrhythmia, and respiratory artifact[J]. J Hum Hypertens, 2024, 38(1): 45-51. DOI:10.1038/s41371-023-00856-4 |
| [12] | Kaufmann T, Cox EGM, Wiersema R, et al. Non-invasive oscillometric versus invasive arterial blood pressure measurements in critically ill patients: a post hoc analysis of a prospective observational study[J]. J Crit Care, 2020, 57: 118-123. DOI:10.1016/j.jcrc.2020.02.013 |
| [13] | Link MS, Berkow LC, Kudenchuk PJ, et al. Part 7: adult advanced cardiovascular life support: 2015 American heart association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2015, 132(18 Suppl 2): S444-S464. DOI:10.1161/CIR.0000000000000261 |
| [14] | 中国医师协会体外生命支持专业委员会. 成人体外膜氧合循环辅助专家共识[J]. 中华重症医学电子杂志(网络版), 2018, 4(2): 114-122. DOI:10.3877/cma.j.issn.2096-1537.2018.02.003 |
| [15] | Wyckoff MH, Greif R, Morley PT, et al. 2022 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations: summary from the basic life support; advanced life support; pediatric life support; neonatal life support; education, implementation, and teams; and first aid task forces[J]. Resuscitation, 2022, 181: 208-288. DOI:10.1016/j.resuscitation.2022.10.005 |
| [16] | Berg KM, Bray JE, Ng KC, et al. 2023 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations: summary from the basic life support; advanced life support; pediatric life support; neonatal life support; education, implementation, and teams; and first aid task forces[J]. Circulation, 2023, 148(24): e187-e280. DOI:10.1161/CIR.0000000000001179 |
| [17] | Lemiale V, Dumas F, Mongardon N, et al. Intensive care unit mortality after cardiac arrest: the relative contribution of shock and brain injury in a large cohort[J]. Intensive Care Med, 2013, 39(11): 1972-1980. DOI:10.1007/s00134-013-3043-4 |
| [18] | Poppe M, Weiser C, Holzer M, et al. The incidence of "load & go" out-of-hospital cardiac arrest candidates for emergency department utilization of emergency extracorporeal life support: a one-year review[J]. Resuscitation, 2015, 91: 131-136. DOI:10.1016/j.resuscitation.2015.03.003 |
| [19] | Aziz S, Barratt J, Starr Z, et al. The association between intra-arrest arterial blood pressure and return of spontaneous circulation in out-of-hospital cardiac arrest[J]. Resuscitation, 2024, 205: 110426. DOI:10.1016/j.resuscitation.2024.110426 |
| [20] | Berg RA, Morgan RW, Reeder RW, et al. Diastolic blood pressure threshold during pediatric cardiopulmonary resuscitation and survival outcomes: a multicenter validation study[J]. Crit Care Med, 2023, 51(1): 91-102. DOI:10.1097/CCM.0000000000005715 |
| [21] | Hsu CH, Meurer WJ, Domeier R, et al. Extracorporeal cardiopulmonary resuscitation for refractory out-of-hospital cardiac arrest (EROCA): results of a randomized feasibility trial of expedited out-of-hospital transport[J]. Ann Emerg Med, 2021, 78(1): 92-101. DOI:10.1016/j.annemergmed.2020.11.011 |
| [22] | Yukawa T, Kashiura M, Sugiyama K, et al. Neurological outcomes and duration from cardiac arrest to the initiation of extracorporeal membrane oxygenation in patients with out-of-hospital cardiac arrest: a retrospective study[J]. Scand J Trauma Resusc Emerg Med, 2017, 25(1): 95. DOI:10.1186/s13049-017-0440-7 |
| [23] | Adstamongkonkul D, Hess DC. Ischemic Conditioning and neonatal hypoxic ischemic encephalopathy: a literature review[J]. Cond Med, 2017, 1(1): 9-16. |
| [24] | Obling LER, Beske RP, Meyer MAS, et al. Inflammatory response after prehospital high-dose glucocorticoid to patients resuscitated from out-of-hospital cardiac arrest: a sub-study of the STEROHCA trial[J]. Resuscitation, 2024, 202: 110340. DOI:10.1016/j.resuscitation.2024.110340 |
| [25] | Janiczek JA, Winger DG, Coppler P, et al. Hemodynamic resuscitation characteristics associated with improved survival and shock resolution after cardiac arrest[J]. Shock, 2016, 45(6): 613-619. DOI:10.1097/SHK.0000000000000554 |
| [26] | Beylin ME, Perman SM, Abella BS, et al. Higher mean arterial pressure with or without vasoactive agents is associated with increased survival and better neurological outcomes in comatose survivors of cardiac arrest[J]. Intensive Care Med, 2013, 39(11): 1981-1988. DOI:10.1007/s00134-013-3075-9 |
| [27] | Khanduja S, Kim J, Kang JK, et al. Hypoxic-ischemic brain injury in ECMO: pathophysiology, neuromonitoring, and therapeutic opportunities[J]. Cells, 2023, 12(11): 1546. DOI:10.3390/cells12111546 |
| [28] | Paul M, Bougouin W, Geri G, et al. Delayed awakening after cardiac arrest: prevalence and risk factors in the Parisian registry[J]. Intensive Care Med, 2016, 42(7): 1128-1136. DOI:10.1007/s00134-016-4349-9 |
| [29] | Trzeciak S, Jones AE, Hope Kilgannon J, et al. Significance of arterial hypotension after resuscitation from cardiac arrest[J]. Crit Care Med, 2009, 37(11): 2895-2903;quiz2904. DOI:10.1097/ccm.0b013e3181b01d8c |
| [30] | Panchal AR, Bartos JA, Cabañas JG, et al. Part 3: adult basic and advanced life support: 2020 American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S366-S468. DOI:10.1161/CIR.0000000000000916 |
| [31] | Guglin M, Zucker MJ, Bazan VM, et al. Venoarterial ECMO for adults: JACC scientific expert panel[J]. J Am Coll Cardiol, 2019, 73(6): 698-716. DOI:10.1016/j.jacc.2018.11.038 |
| [32] | Vincent JL, Ince C, Bakker J. Clinical review: circulatory shock: an update: a tribute to professor max harry Weil[J]. Crit Care, 2012, 16(6): 239. DOI:10.1186/cc11510 |
| [33] | Ubben JFH, Heuts S, Delnoij TSR, et al. Extracorporeal cardiopulmonary resuscitation for refractory OHCA: lessons from three randomized controlled trials-the trialists' view[J]. Eur Heart J Acute Cardiovasc Care, 2023, 12(8): 540-547. DOI:10.1093/ehjacc/zuad071 |
| [34] | Inoue A, Hifumi T, Sakamoto T, et al. Extracorporeal cardiopulmonary resuscitation in adult patients with out-of-hospital cardiac arrest: a retrospective large cohort multicenter study in Japan[J]. Crit Care, 2022, 26(1): 129. DOI:10.1186/s13054-022-03998-y |
| [35] | Suverein MM, Maessen JG, van de Poll MCG. Extracorporeal cardiopulmonary resuscitation in out-of-hospital cardiac arrest - current status[J]. Curr Opin Crit Care, 2023, 29(6): 633-639. DOI:10.1097/MCC.0000000000001102 |
 2025, Vol. 34
2025, Vol. 34