危重症患者病情复杂且常合并血糖代谢的紊乱,血糖代谢的紊乱程度不仅反映原发疾病的严重程度,在一定程度上也会造成其原发疾病的救治困难,甚至延长患者住院时间和增加死亡风险[1]。故此,危重症患者的血糖监测已经成为基本监测内容之一。随着科学技术的发展,血糖监测逐步从人工测量方法向自动定量分析方法发展,在普通门诊等医院环境中使用扫描式葡萄糖监测(flash glucose monitoring, FGM)技术的准确度已得到广泛认可[2],该技术在重症患者中的应用逐渐增加但尚未推广使用,其准确度和可靠性在不同研究中存在较大差异。尽管有研究表明在ICU中使用连续动态血糖监测技术是相对准确的[3],且与动脉血糖监测技术相比,可相对提高目标血糖达标时间并减少低血糖事件的发生[4-5],但其成本效益仍有待进一步研究证实。现有危重症患者扫描式葡萄糖监测研究大多集中在监测数据的安全准确度[6]、与其他床旁血糖监测方法的对比[7]以及测量数据的波动趋势[8]等方面,对于危重症患者FGM技术准确度影响因素的相关研究尚显薄弱。保障FGM准确度是推动其从辅助工具升级为血糖管理标准的核心前提,适当调整危重症个体可控因素可在机体极端血糖状态下进一步保证其应用可靠性。因此,本研究采用Bland-Altman分析法评价危重症患者中FGM血糖测定的准确度,并探讨其影响因素,以期为医护人员更科学准确的在危重症患者中应用FGM提供借鉴和参考依据。
1 资料与方法 1.1 研究对象选取2022年9月至2023年12月于苏州大学附属第二医院ICU就诊的使用FGM血糖监测的危重症患者的53例临床资料进行分析。脓毒血症诊断依据《第三版脓毒症与感染性休克定义的国际共识》(简称脓毒症3.0)进行诊断筛选[9]。研究按照医学伦理学标准施行,并经苏州大学附属第二医院伦理委员会(伦理审批号:JD-LK-2018-065-02)。
(1)纳入标准:①年龄≥18岁,符合应激性高血糖的诊断标准[10-11];②与患者家属充分沟通后同意进行该研究,并签署知情同意书。(2)排除标准:①3 d内出院或死亡患者;②研究期间中途退出或其他各种原因未完成本研究者。
1.2 标本采集与血糖测量在与患者家属充分沟通并签署知情同意书后,即刻佩戴雅培辅理善动态扫描式葡萄糖监测仪。采用2种不同方法测定血糖水平统计从基线血糖和终点血糖的所有指标。动脉血-血气分析仪法:医生下达采取动脉血气医嘱后,5 min内采集动脉血样本。为避免血标本稀释或污染,在留置动脉导管的动脉血抽取时先抽取5 mL动脉血丢弃后再抽取1~2 mL进行动脉血气分析仪(美国GEM3500沃芬全自动血气分析仪)测定血糖数据,与此同时读取监测仪此刻时间点的血糖数据进行配对分析。所有仪器严格执行质量控制标准要求,均按照说明书和实验室质量控制程序进行质量控制,检测过程中严格按照说明书进行操作。
1.3 观察指标收集符合纳排标准所有患者的性别、年龄、身高、体重、BMI,以及测定血糖时的APACHEⅡ评分、平均动脉压、白细胞、C-反应蛋白、降钙素原、前白蛋白、白蛋白、ICU住院天数、是否脓毒血症及血糖指标等相关资料。
1.4 血糖准确度判定标准准确度是指血糖仪的测量结果与实验室血糖检测结果之间的一致程度[12]。目前大多研究者以肘正中静脉血送检实验室监测的血糖值作为患者血糖监测结果的金标准与可靠值,而在危重症患者中,中心实验室测得静脉血糖与动脉血糖的一致性较好[13-14]。考虑患者经济成本与实际监测血标本时限性原因,本研究以患者动脉血气分析仪分析结果作为危重症患者FGM血糖监测准确度的参考标准。根据中国血糖监测临床应用指南对准确度的要求[12]划定危重症患者FGM血糖监测与动脉血糖结果配对数据是否准确:当血糖浓度<5.5 mmol/L时,至少95%的检测结果差异在±0.83 mmol/L的范围内,或当血糖浓度≥5.5 mmol/L时,至少95%的检测结果差异在±15 %的范围内,则判定为FGM血糖监测结果与动脉血糖结果配对数据准确,否则为FGM血糖监测配对数据不准确。当同一个体出现FGM血糖监测配对数据不准确次数≥2次时判定为FGM血糖监测非准确组,否则为FGM血糖监测准确组。
1.5 统计学方法采用Excel 2019建立数据库并双人录入数据,采用SPSS 26.0、MedCalc 20.0统计软件对数据进行统计分析。数据符合正态分布,计量资料以均数±标准差(x±s)表示,计数资料以频数(百分比)表示。不同人口学特征下危重症患者动脉与FGM血糖准确度的单因素分析结果比较采用t检验、χ2检验。二元Logistic回归方程模型的构建共形成3个模型:模型1以单因素筛选P<0.1纳入构建二元Logistic回归方程;模型2在模型1的基础上将一般人口学变量中常用的年龄、性别变量纳入构建二元Logistic回归方程;模型3考虑纳入自变量个数为14个,血糖配对数量是自变量个数20倍以上,且多重共线性符合要求,因此将自变量全部纳入。床旁即时血糖检测方法(动脉血糖与FGM血糖)间的一致性评估采用Bland-Altman法分析测定结果的偏倚程度(偏倚定义为2种床旁即时血糖检测方法血糖检测值与标准法血糖检测值的差值的均数),并计算95%置信区间(95%CI)。以P<0.05认为差异有统计学意义。
2 结果共选取53例使用FGM血糖监测的危重症患者临床资料进行分析,共收集到FGM血糖监测数据1 760个,动脉血糖监测数据504个,动脉血糖与FGM血糖一致性评估配对数据504对。
2.1 危重症患者FGM血糖监测准确度的单因素分析根据FGM血糖监测准确情况,分为准确组16例与非准确组37例,对研究对象的人口学特征进行分析,结果如表 1所示。
| 变量 | 准确组(n=16) | 非准确组(n=37) | t/χ2值 | P值 |
| 性别a | 0.164 | 0.685 | ||
| 男 | 12 (22.64) | 24 (45.28) | ||
| 女 | 4 (7.55) | 13 (24.53) | ||
| 年龄(岁)b | 60.94±15.09 | 67.57±16.69 | 1.365 | 0.178 |
| 身高(cm)b | 166.46±10.20 | 167.95±9.27 | 0.439 | 0.664 |
| 体重(kg)b | 66.42±19.22 | 66.21±11.97 | -0.035 | 0.972 |
| BMI (kg/m2)b | 24.20±4.61 | 23.69±3.73 | -0.423 | 0.674 |
| APACHEⅡ评分(分)b | 18.31±6.81 | 21.81±6.74 | 1.730 | 0.090 |
| 平均动脉压b | 86.24±15.81 | 81.07±12.53 | -1.273 | 0.209 |
| 白细胞(×109/L) | 13.31±5.89 | 13.84±5.59 | -0.428 | 0.671 |
| C-反应蛋白(g/L)b | 142.31±109.15 | 125.33±82.37 | -0.623 | 0.536 |
| 降钙素原(ng/mL)b | 32.57±43.14 | 13.91±22.49 | -2.074 | 0.043 |
| 前白蛋白(g/L)b | 0.10±0.06 | 0.10±0.05 | -0.515 | 0.609 |
| 白蛋白(g/L)b | 29.59±6.63 | 35.74±30.50 | -0.794 | 0.431 |
| ICU住院天数(d)b | 14.25±12.05 | 18.11±30.28 | 0.491 | 0.625 |
| 是否脓毒血症a | 0.901 | 0.343 | ||
| 是 | 12 (22.64) | 21 (39.62) | ||
| 否 | 4 (7.55) | 16 (30.19) | ||
| 注:a为例(%),b为x±s;BMI为体重指数,APACHEⅡ急性生理与慢性健康评分Ⅱ | ||||
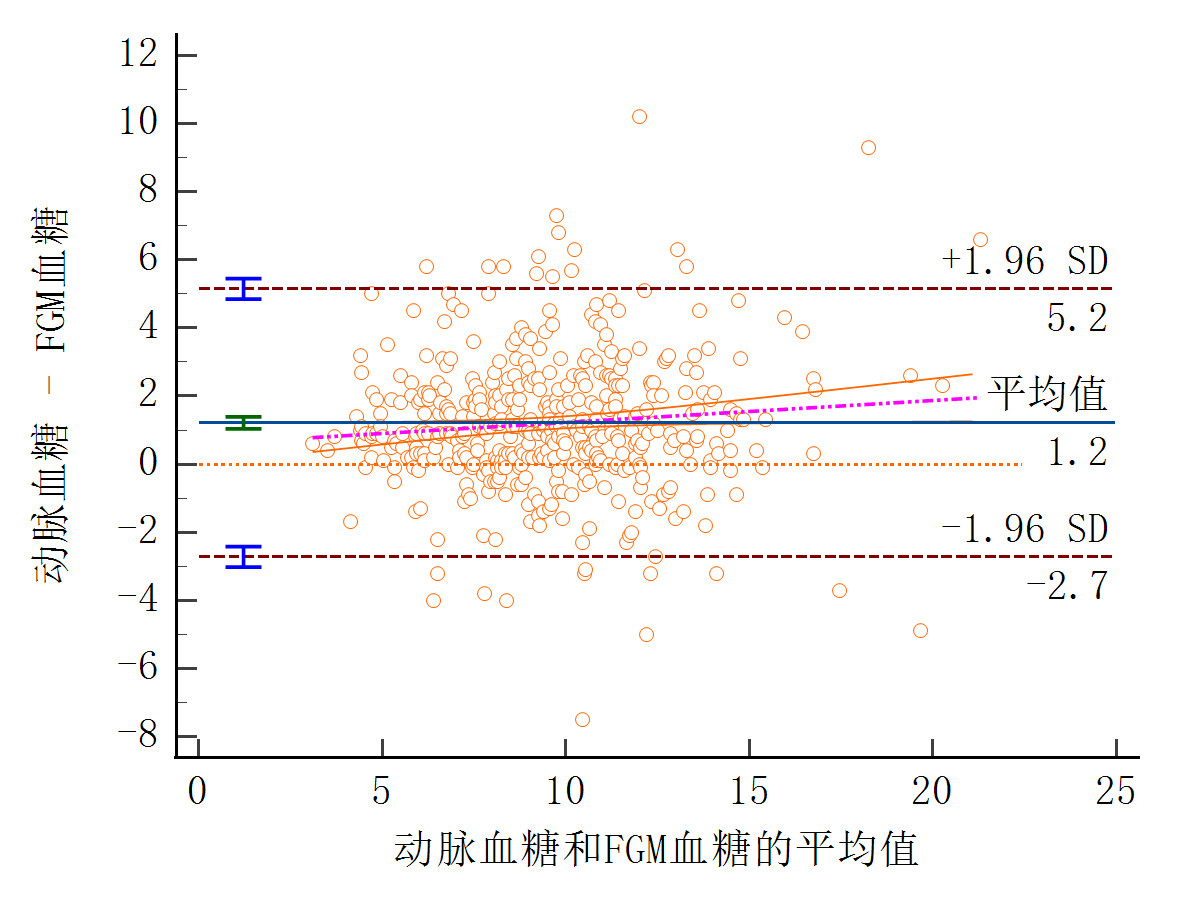
将动脉血糖与FGM血糖504对配对数据进行一致性评估,采用Bland-Altman分析法,分析这两种床旁即时血糖检测方法测定结果的偏倚程度,结果显示,与动脉-血气分析血糖值比较,FGM血糖平均偏倚值明显升高,其血糖平均偏倚值为1.215 mmol/L,95%一致性界限范围为(95%CI: 1.0394~1.3908),超上、下限范围发生率6.349%,差异具有统计学意义(P<0.001)。见图 1。
|
| 图 1 动脉血糖与FGM血糖数据Bland-Altman分析对比图 Fig 1 Comparison of Bland-Altman analysis of arterial blood glucose and FGM glucose data |
|
|
纳入APACHEⅡ评分、降钙素原等协变量构建二元Logistic回归方程,共构建形成模型三个,分别为模型1、模型2和模型3。考虑Hosmer-Lemeshow检验拟合优度指标,以模型3为最优模型,模型拟合优度效果较好(P=0.419),见表 2。其中,最优模型检验情况:多重共线性检验结果中,容忍度(Tolerance)范围在0.384~0.851之间,均大于0.1;方差膨胀因子(VIF)范围在1.175~2.605之间,均小于5,说明回归模型中变量不存在严重共线性问题,可进行下一步操作。模型系数的Omnibus综合检验结果中,P=0.001,最优模型整体有意义。
| 模型 | B | 标准误差(S.E) | Wald | P | OR | 95%CI | Hosmer-Lemeshow检验 | ||
| 下限 | 上限 | χ2值 | P值 | ||||||
| Model 1 | 12.643 | 0.125 | |||||||
| APACHEⅡ评分 | -0.024 | 0.013 | 3.523 | 0.061 | 0.976 | 0.951 | 1.001 | ||
| PCT | 0.007 | 0.004 | 3.092 | 0.079 | 1.007 | 0.999 | 1.015 | ||
| 常量a | 0.617 | 0.288 | 4.601 | 0.032 | 1.853 | — | — | ||
| Model 2 | 17.299 | 0.016 | |||||||
| 年龄(岁) | -0.025 | 0.013 | 3.420 | 0.064 | 0.975 | 0.95 | 1.001 | ||
| 性别 | 0.007 | 0.004 | 3.171 | 0.075 | 1.007 | 0.999 | 1.015 | ||
| APACHEⅡ评分 | 0.000 | 0.006 | 0.001 | 0.973 | 1.000 | 0.988 | 1.012 | ||
| PCT | -0.055 | 0.198 | 0.076 | 0.783 | 0.947 | 0.643 | 1.395 | ||
| 常量 | 0.655 | 0.472 | 1.923 | 0.165 | 1.925 | — | — | ||
| Model 3 | 7.099 | 0.419 | |||||||
| 年龄(岁) | -0.019 | 0.014 | 1.832 | 0.176 | 0.981 | 0.954 | 1.009 | ||
| 身高(cm)a | -0.131 | 0.060 | 4.758 | 0.029 | 0.877 | 0.780 | 0.987 | ||
| 体重(kg) | 0.139 | 0.078 | 3.166 | 0.075 | 1.149 | 0.986 | 1.338 | ||
| BMI(kg/m2) | -0.34 | 0.215 | 2.516 | 0.113 | 0.712 | 0.467 | 1.083 | ||
| APACHEⅡ评分 | -0.023 | 0.026 | 0.777 | 0.378 | 0.978 | 0.929 | 1.028 | ||
| 平均动脉压 | -0.019 | 0.015 | 1.513 | 0.219 | 0.982 | 0.953 | 1.011 | ||
| 白细胞a | -0.087 | 0.028 | 9.464 | 0.002 | 0.917 | 0.868 | 0.969 | ||
| CRP a | 0.009 | 0.004 | 5.777 | 0.016 | 1.009 | 1.002 | 1.017 | ||
| PCT | 0.005 | 0.009 | 0.337 | 0.561 | 1.005 | 0.988 | 1.023 | ||
| PABb | -5.415 | 4.673 | 1.343 | 0.247 | 0.004 | 0.000 | 42.272 | ||
| ALB a | -0.014 | 0.006 | 4.669 | 0.031 | 0.986 | 0.974 | 0.999 | ||
| ICU住院天数(d) | -0.011 | 0.007 | 2.147 | 0.143 | 0.989 | 0.975 | 1.004 | ||
| 性别 | |||||||||
| 男b | — | — | — | — | 1.000 | — | — | ||
| 女 | -1.246 | 0.699 | 3.173 | 0.075 | 0.288 | 0.073 | 1.133 | ||
| 是否脓毒血症a | |||||||||
| 否b | — | — | — | — | 1.000 | — | — | ||
| 是 | 1.370 | 0.610 | 5.051 | 0.025 | 3.937 | 1.192 | 13.008 | ||
| 常量 | 24.748 | 9.903 | 6.245 | 0.012 | 55.960 | — | — | ||
| 注:aP<0.05;b为参照组;PCT为降钙素原,BMI为体重指数,APACHEⅡ为急性生理与慢性健康评分Ⅱ,CRP为C-反应蛋白,PAB为前白蛋白,ALB为白蛋白,ICU为重症监护室 | |||||||||
最优模型(模型3)结果发现:以动脉血气分析仪测定的动脉血糖值为参考指标,身高的变化(OR=0.877,95%CI: 0.780~0.987,P=0.029)、白细胞计数变化(OR=0.917,95%CI: 0.868~0.969,P=0.002)、C-反应蛋白变化(OR=1.009,95%CI: 1.002~1.017,P=0.016)、白蛋白计数变化(OR=0.986,95%CI: 0.974~0.999,P=0.031)以及是否脓毒血症(OR=3.937,95%CI: 1.192~13.008,P=0.025)对FGM准确度的影响具有统计学意义。
3 讨论 3.1 与动脉-血气分析血糖值比较,FGM单点血糖数据平均偏倚值升高本研究Bland-Altman分析结果表明,与动脉-血气分析血糖值比较,FGM血糖平均偏倚值升高,超上、下限范围发生率为6.349%,超出可接受限度5%,且研究差异具有统计学意义,这表明FGM的单点血糖数据相对于动脉血气分析结果而言准确度较低,与国外一项大型Meta分析结果一致[13]。但就临床意义而言,血糖指数如血糖变异性、血糖目标范围内控制时间等趋势变化会影响危重症患者预后[14],FGM系统可生成血糖趋势图并进行总结报告,能更深入了解危重症患者血糖整体的波动情况和变化趋势[15],可为临床医师在制订血糖控制方案时提供较大的参考价值。来自一项日本的研究结果也表明,尽管FGM的单点血糖数据始终低于动脉血气分析的血糖数据值,但99.4%的读数处于临床可接受的准确度范围内,在危重症患者连续佩戴14 d的时间周期内具有可接受的可靠性和准确性[8]。因此,在危重症血糖管理中,尽管动脉血糖监测方法更具准确性,但随着科学技术的发展,血糖监测将逐步从人工测量方法向自动定量分析方法发展[16]。尽管研究者们对FGM系统技术的研究结果存在争议,但研究者们肯定的是FGM技术的应用价值值得进一步研究[17]。
3.2 危重症患者的身高、白细胞、C-反应蛋白、白蛋白是FGM血糖监测准确度的影响因素本研究结果表明,身高是影响FGM血糖监测准确度的主要人口学特征之一,而年龄、性别对于FGM系统监测血糖的准确度影响不大,这与美国的一项研究结果类似[18]。此外,国内研究也显示,不同年龄不是影响脓毒血症患者指尖血糖准确度的因素[19]。关于“身高影响危重症患者扫描式葡萄糖监测技术准确度”的探讨,目前在医学领域并没有直接的研究或权威论述表明身高是一个主要因素。分析本研究结果的主要原因,可能与某些生理特征或疾病风险相关联,这些特征或风险可能间接影响血糖监测的准确度。有研究表明身高与血糖波动以及血糖相关不良结局风险增加相关[20],但这种相关性更多是在一般人群或孕妇中观察到的,而非特指危重症患者。此外,身高可能与BMI、体脂分布等因素有关,这些因素可能影响组织间液与血糖之间的平衡,从而间接影响扫描式葡萄糖监测系统的准确度,但这种影响通常是通过复杂的生理机制实现的,并非身高本身直接导致。身高是否影响危重症患者FGM血糖监测准确度结果仍需大样本研究数据进一步探讨。
白细胞计数变化和C-反应蛋白变化同样是影响FGM血糖监测准确度的主要因素之一,这意味着人体感染程度会直接影响FGM血糖监测准确度。分析其主要机制,现有证据提示可能存在炎症代谢干扰和传感器局部生物污染等潜在关联机制。危重症患者机体白细胞计数变化常提示个体全身性炎症反应,而炎症因子[如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]可能通过抑制胰岛素信号通路,导致组织葡萄糖摄取异常,使组织间质葡萄糖(动态血糖监测对象)与血液葡萄糖(金标准)的梯度关系发生改变[21-22]。此外,机体炎症状态下毛细血管通透性增加,可能延缓葡萄糖从血管内向间质扩散的时间,造成连续动态监测血糖读数滞后[23-24],进而影响监测结果准确度。长期植入的FGM传感器也可能被白细胞(尤其是中性粒细胞)分泌的活性氧簇(ROS)和蛋白酶降解,导致电极敏感度下降。动物模型显示,高白细胞计数环境中传感器信号漂移率增加15%~20%[25]。关于白细胞计数变化影响FGM准确度的机制研究,现有证据提示可能存在炎症代谢干扰和传感器局部生物污染等潜在关联机制,但以上研究局限于观察性数据[26],仍需更多大样本随机对照试验明确白细胞亚群的具体影响。
本研究结果提示,白蛋白变化是影响FGM血糖监测准确度的主要因素之一,这可能与机体白蛋白变化通过直接干扰糖化白蛋白的测量以及改变组织间液葡萄糖动力学等机制状态改变有关。危重症患者常常存在营养不良、肝功能受损或炎症等情况,由于多种生理病理变化,白蛋白的水平可能会发生变化,白蛋白是个体形成糖化白蛋白(glycated albumin, GA)的基础,其浓度和周转率的变化会直接影响GA的测量值[27],进而会影响葡萄糖在组织间液和血浆之间的分布和转运,从而影响FGM血糖监测的准确度[28]。此外,高蛋白血症或低蛋白血症可能改变动态监测血糖传感器表面分子结合效率,部分校准算法可能整合血清生物标志物GA,从而导致检测信号结果误差[29]。临床中仍建议针对白蛋白异常患者进行FGM数据的校正或联合其他监测方法以提高准确度。
3.3 脓毒血症患者相比其他危重症患者的FGM准确度不同本研究结果显示,脓毒血症患者是影响FGM血糖监测准确度的主要因素之一。以往研究也发现[21],相较于危重症患者的动脉血结果,脓毒血症休克患者的末梢血糖也具有更宽的一致性界限范围,超上、下限范围发生率为5.7%。机制研究显示,脓毒症早期因“炎症风暴”导致的炎症因子释放及氧化应激过度激活,血糖应激性升高能诱导内毒素释放,抑制中性粒细胞的趋化及杀菌能力,使全身性炎症反应综合征呈级联反应放大,形成“炎症-高血糖-炎症”的恶性循环[22-23]。而脓毒血症患者相较于ICU其他危重症患者,具有缺氧、组织灌注不足、全身炎症反应、酸中毒、低红细胞压积等临床特点,全身炎症反应和血管内皮损伤会导致外周组织微循环障碍及组织间液动力学改变。由于FGM主要通过测量皮下组织间液葡萄糖浓度间接反映血糖水平,但在低灌注状态下,尤其血管活性药物使用期间,组织间液与血浆葡萄糖的平衡时间显著延长,从而导致动态血糖监测存在延迟偏差[33]。多项研究结果也显示,患者异常pH值与红细胞压积[34]、血浆水分的含量[35]、氧分压和氧化/还原物质,以及抗氧化剂如抗坏血酸药物[36]等均会干扰测量血糖所需的电化学反应过程。此外,研究结果[19, 37]还提示,红细胞压积是影响血糖监测准确度的因素之一,当超出35%~55%区间时,需注意监测血糖数据的准确性。总之,血糖监测常受机体内外因素影响产生波动,因此,当要获取血糖单点数值时,推荐采用动脉血糖检测方法实时评估脓毒症患者血糖水平方法更为准确[31]。而将FGM系统应用于脓毒血症患者对测定整体血糖趋势有着绝对优势,且随着同步监测技术的成熟可能会激发临床开发新的、更有效和安全的危重症患者血糖控制方案。
综上所述,本研究结果显示,与动脉血气分析血糖值比较,FGM血糖监测准确度较低,其影响因素涉及身高、白细胞、C-反应蛋白、白蛋白以及是否脓毒血症。尽管与动脉血气分析血糖值比较,FGM血糖监测结果存在争议,如平均偏倚值相对升高,但将FGM系统应用于脓毒血症患者对测定整体血糖趋势有着绝对优势,研究者们可以肯定的是扫描式葡萄糖监测技术的应用价值值得进一步研究。此次研究样本仅选取苏州市级的样本量,可能存在样本量不足或偏差等局限性,具体研究结果仍需大样本试验进一步证实。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赵丽爽:研究设计、统计分析、文章撰写;陆娟:研究落实推进、文章修改校对;朱建军、刘励军:质量控制、专家咨询;詹静晔、包群英、田晓艳:数据收集及整理、数据校对
| [1] | Wallia A, Umpierrez GE, Rushakoff RJ, et al. Consensus statement on inpatient use of continuous glucose monitoring[J]. J Diabetes Sci Technol, 2017, 11(5): 1036-1044. DOI:10.1177/1932296817706151 |
| [2] | Clubbs Coldron B, Coates V, Khamis A, et al. Use of continuous glucose monitoring in non-ICU hospital settings for people with diabetes: a scoping review of emerging benefits and issues[J]. J Diabetes Sci Technol, 2023, 17(2): 467-473. DOI:10.1177/19322968211053652 |
| [3] | Kosiborod M, Gottlieb RK, Sekella JA, et al. Performance of the Medtronic Sentrino continuous glucose management (CGM) system in the cardiac intensive care unit[J]. BMJ Open Diabetes Res Care, 2014, 2(1): e000037. DOI:10.1136/bmjdrc-2014-000037 |
| [4] | Wang Y, Li S, Lu J, et al. Threshold of hyperglycaemia associated with mortality in critically ill patients: a multicentre, prospective, observational study using continuous glucose monitoring[J]. Diabetologia, 2024, 67(7): 1295-1303. DOI:10.1007/s00125-024-06136-1 |
| [5] | Yao Y, Zhao Y, Zheng W, et al. Subcutaneous continuous glucose monitoring in critically ill patients during insulin therapy: a meta-analysis[J]. Am J Transl Res, 2022, 14(7): 4757-4767. |
| [6] | Huang WF, Li SW, Lu JY, et al. Accuracy of the intermittently scanned continuous glucose monitoring system in critically ill patients: a prospective, multicenter, observational study[J]. Endocrine, 2022, 78(3): 470-475. DOI:10.1007/s12020-022-03216-3 |
| [7] | Wright JJ, Williams AJ, Friedman SB, et al. Accuracy of continuous glucose monitors for inpatient diabetes management[J]. J Diabetes Sci Technol, 2023, 17(5): 1252-1255. DOI:10.1177/19322968221076562 |
| [8] | Naraba H, Goto T, Tokuda M, et al. Accuracy and stability of a subcutaneous flash glucose monitoring system in critically ill patients[J]. J Diabetes Sci Technol, 2022, 16(5): 1128-1135. DOI:10.1177/19322968211017203 |
| [9] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [10] | 施小红. 重型颅脑损伤患者应激性高血糖的护理进展[J]. 中华现代护理杂志, 2013(28): 3563-3566. DOI:10.3760/cma.j.issn.1674-2907.2013.28.044 |
| [11] | Orford NR. Intensive insulin therapy in septic shock[J]. Crit Care Resusc, 2006, 8(3): 230-234. |
| [12] | 中华医学会糖尿病学分会. 中国血糖监测临床应用指南(2015年版)[J]. 中华糖尿病杂志, 2015, 7(10): 603-613. DOI:10.3760/cma.j.issn.1674-5809.2015.10.004 |
| [13] | Arias-Rivera S, Raurell-Torredà M, Fernández-Castillo RJ, et al. Blood glucose monitoring in critically ill adult patients: type of sample and method of analysis. Systematic review and meta-analysis[J]. Enferm Intensiva (Engl Ed), 2024, 35(1): 45-72. DOI:10.1016/j.enfie.2023.02.002 |
| [14] | Juneja D, Deepak D, Nasa P. What, why and how to monitor blood glucose in critically ill patients[J]. World J Diabetes, 2023, 14(5): 528-538. DOI:10.4239/wjd.v14.i5.528 |
| [15] | 余麟, 马月秋, 伍晓梅, 等. 妊娠合并糖尿病患者血糖监测技术及管理指标研究进展[J]. 中国计划生育学杂志, 2023, 31(11): 2779-2784. |
| [16] | 顾琼, 朱湘筠, 曹伟中, 等. 危重症患者的个体化血糖控制进展[J]. 中华急诊医学杂志, 2023, 32(6): 833-836. DOI:10.3760/cma.j.issn.1671-0282.2023.06.024 |
| [17] | Salinas PD, Mendez CE. Glucose management technologies for the critically ill[J]. J Diabetes Sci Technol, 2019, 13(4): 682-690. DOI:10.1177/1932296818822838 |
| [18] | Bailey T, Bode BW, Christiansen MP, et al. The performance and usability of a factory-calibrated flash glucose monitoring system[J]. Diabetes Technol Ther, 2015, 17(11): 787-794. DOI:10.1089/dia.2014.0378 |
| [19] | 贺盼盼. 脓毒症患者指尖血糖与动脉血糖差异性研究及相关影响因素分析[D]. 石家庄: 河北医科大学, 2020. DOI: 10.27111/d.cnki.ghyku.2020.000046. |
| [20] | Chu AHY, Yuan WL, Loy SL, et al. Maternal height, gestational diabetes mellitus and pregnancy complications[J]. Diabetes Res Clin Pract, 2021, 178: 108978. DOI:10.1016/j.diabres.2021.108978 |
| [21] | Adane T, Melku M, Worku YB, et al. The Association between Neutrophil-to-Lymphocyte Ratio and Glycemic Control in Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis[J]. J Diabetes Res, 2023: 3117396. DOI:10.1155/2023/3117396 |
| [22] | Serhatlioglu F, Cetinkaya Z, Yilmaz Y. The Role of Glucose-Lymphocyte Ratio in Evaluating the Severity of Coronary Artery Disease[J]. J Clin Med, 2024, 13(22): 6711. DOI:10.3390/jcm13226711 |
| [23] | Gao M, Guo D, Wang J, et al. High-accuracy noninvasive continuous glucose monitoring using OCT angiography-purified blood scattering signals in human skin[J]. Biomed Opt Express, 2024, 15(2): 991-1003. DOI:10.1364/BOE.506092 |
| [24] | Kumari R, Anand P K, Shin J. Improving the Accuracy of Continuous Blood Glucose Measurement Using Personalized Calibration and Machine Learning[J]. Diagnostics (Basel), 2023, 13(15): 2514. DOI:10.3390/diagnostics13152514 |
| [25] | Tong X, Jiang T, Yang J, et al. Continuous glucose monitoring (CGM) system based on protein hydrogel anti-biofouling coating for long-term accurate and point-of-care glucose monitoring[J]. Biosens Bioelectron, 2025, 277: 117307. DOI:10.1016/j.bios.2025.117307 |
| [26] | Yang T, Zhao B, Guan X, et al. White cell count trajectory and type 2 diabetes in health management population: a retrospective cohort study[J]. BMJ Open, 2022, 12(9): e057966. DOI:10.1136/bmjopen-2021-057966 |
| [27] | Ghosh Dastidar M, Murugappan K, R Nisbet D, et al. Simultaneous electrochemical detection of glycated and human serum albumin for diabetes management[J]. Biosens Bioelectron, 2024, 246: 115876. DOI:10.1016/j.bios.2023.115876 |
| [28] | 黄卫鹏. 基于扫描式葡萄糖监测系统评估平均葡萄糖与糖化清蛋白之间的相关性及其影响因素分析[D]. 广州: 南方医科大学, 2022. DOI: 10.27003/d.cnki.gojyu.2022.000671. |
| [29] | Xie J, Wang Z, Zhang Z, et al. Adjusted glycated albumin is a novel indicator of glycemic control in patients with macroalbuminuria in diabetic kidney disease[J]. Sci Rep, 2025, 15(1): 13812. DOI:10.1038/s41598-025-98641-5 |
| [30] | 吴燕丽, 邢柏. 脓毒性休克患者动脉血及末梢血床旁即时血糖检测准确性的研究[J]. 临床急诊杂志, 2020, 21(4): 312-318. DOI:10.13201/j.issn.1009-5918.2020.04.012 |
| [31] | 陈伟, 沈琦, 陈虞红. 血糖变异系数对急诊脓毒症患者脓毒症相关性脑病的预测价值[J]. 中国急救医学, 2024, 44(9): 815-821. DOI:10.3969/j.issn.1002-1949.2024.09.016 |
| [32] | Qosimah D, Aryani DE, Beltran MAG, et al. Diabetes sepsis on Wistar rat strain (Rattus norvegicus) induced by streptozotocin and bacteria Staphylococcus aureus[J]. Vet World, 2019, 12(6): 849-854. DOI:10.14202/vetworld.2019.849-854 |
| [33] | Friman O, Soltani N, Lind M, et al. Performance of Subcutaneous Continuous Glucose Monitoring in Adult Critically Ill Patients Receiving Vasopressor Therapy[J]. Diabetes Technol Ther, 2024, 26(10): 763-772. DOI:10.1089/dia.2024.0035 |
| [34] | Tang Z, Louie RF, Lee JH, et al. Oxygen effects on glucose meter measurements with glucose dehydrogenase- and oxidase-based test strips for point-of-care testing[J]. Crit Care Med, 2001, 29(5): 1062-1070. DOI:10.1097/00003246-200105000-00038 |
| [35] | Lyon ME, Lyon AW. Patient acuity exacerbates discrepancy between whole blood and plasma methods through error in molality to molarity conversion: "Mind the gap!"[J]. Clin Biochem, 2011, 44(5/6): 412-417. DOI:10.1016/j.clinbiochem.2011.01.005 |
| [36] | Tang Z, Du X, Louie RF, et al. Effects of drugs on glucose measurements with handheld glucose meters and a portable glucose analyzer[J]. Am J Clin Pathol, 2000, 113(1): 75-86. DOI:10.1309/QAW1-X5XW-BVRQ-5LKQ |
| [37] | 国家卫生健康委员会. 便携式血糖仪临床操作和质量管理指南: WS/T 781—2021[S]. 北京: 中国标准出版社, 2021. |
 2025, Vol. 34
2025, Vol. 34