2. 厦门大学附属翔安医院心脏大血管外科,厦门 361100;
3. 厦门大学附属翔安医院急诊医学科,厦门 361100
2. Department of Cardiothoracic and Vascular Surgery, Xiang'an Hospital of Xiamen University, Xiamen 361100;
3. Department of Emergency, Xiang'an Hospital of Xiamen University, Xiamen 361100, China
重症肺炎是致死率较高的急性疾病,尤其在老年人和有基础疾病的患者中更为严重。随着医疗技术的进步,虽然重症肺炎的治疗手段不断改进,但其高病死率仍然是全球公共卫生的重要挑战[1]。肺炎可由多种病原引起,病情发展可导致急性呼吸窘迫综合征及脓毒症等并发症,增加死亡风险[2]。重症肺炎受多种因素影响,包括患者的基础疾病、免疫状态、病程中的并发症等[3-4]。在住院初期,患者是否需要机械通气、是否发生ARDS等因素被认为是较为显著的影响因素[5]。然而,随着病程的延长,死亡的危险因素可能发生变化,且不同的时间段可能有不同的关键因素[6]。了解这些死亡危险因素在不同时间段的变化,对于制定个性化的治疗方案和优化管理具有重要意义。
1 资料与方法 1.1 一般资料研究纳入2019年6月至2020年2月在厦门大学附属翔安医院急诊医学科就诊的134例重症肺炎患者,所有患者均陆续入住EICU病房,根据4年随访生存状态分为死亡组(n=77)和存活组(n=57)。研究经厦门大学附属翔安医院伦理委员会审批同意(XAHLL2025001)。
1.2 入组标准(1)年龄≥18岁;(2)符合中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)中重症肺炎诊断标准[7];(3)首次入院并接受急诊重症监护(EICU)治疗;(4)临床资料和随访数据完整,包括人口学信息、实验室检查结果及治疗记录。
1.3 排除标准(1)明确诊断的严重慢性呼吸系统疾病病史,如括重度慢性阻塞性肺疾病、肺间质纤维化等;(2)非社区获得性肺炎相关疾病导致死亡的患者,如终末期恶性肿瘤、严重肝肾功能衰竭等;(3)普通肺炎或新冠病毒肺炎患者;(4)合并严重系统性疾病或免疫功能缺陷导致肺部感染或严重预后影响者;(5)临床资料缺失或随访信息不完整,无法进行有效生存分析者。
1.4 观察指标 1.4.1 一般资料年龄、性别、BMI(体重指数)和感染类别等。
1.4.2 血液学检查患者入院后,给予血液学检查,罗氏全自动生化分析仪(Roche Diagnostics GMBH,德国慕尼黑,型号Cobas6000 c501)进行生化检查;普门特定蛋白分析仪(深圳普门科技有限公司, PA-990)进行血常规等检测。
1.4.3 APACHEⅡ评分评估重症患者病情严重程度和预后的评分系统。包括3个主要部分:急性生理评分、慢性健康评分和年龄评分。评分总和范围为0~71分,分数越高,表示病情越严重。APACHE-Ⅱ评分是在患者入院后的24 h内,根据入院首日的生命体征、实验室检查结果以及病史等数据计算的。
1.5 随访本研究通过门诊、住院和电话随访,随访截止时间为2025年2月,无失访。所有数据均严格保密并遵循伦理委员会批准的程序。
1.6 统计学方法采用SPSS 23.0软件进行统计学分析。偏态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料以%表示,两组间比较采用χ2检验。正态分布数据以均数±标准差(x±s)表示,组间比较采用独立样本t检验。COX回归分析随访截止时(随访4年)影响重症肺炎死亡的危险因素。Logistic回归分析影响患者住院期间、ICU期间、1月和1年死亡状况的危险因素。各时间节点的死亡分析均以原始134例患者为总体样本,且将“是否在该时间段内死亡”作为因变量进行阶段性回归模型构建。为了避免样本选择偏倚和重复计数,所有时间节点的死亡数据均为累积统计。例如,“1年死亡”组包括1年内死亡的所有患者,这些患者可能已在ICU、住院或1月期间死亡,生存组则为在1年内存活的患者。Kaplan-Meier对影响生存的分类变量进行生存曲线绘制,限制性立方样条图(restricted cubic splines, RCS)用于绘制连续变量与重症肺炎生存状态之间的非线性关系。为确保多变量回归模型的稳健性,针对主要可能存在共线性的变量进行了共线性诊断,采用方差膨胀因子(variance inflation factor, VIF)进行评估。结果显示,各变量VIF均<3,提示模型无明显共线性,保证了回归分析结果的可靠性。以P<0.05表示差异有统计学意义。
2 结果 2.1 一般资料入组患者中,年龄在19~89岁之间,平均70.00(62.75, 79.25)。女性52人,男性82人。两组仅在肌酐、PLT(血小板)、年龄、是否合并慢性心衰、ICU期间发生ARDS(急性呼吸窘迫综合征)和发生AKI(急性肾损伤)之间差异有统计学意义(P<0.05),见表 1。
| 项目 | 总人数(n=134) | 死亡组(n=77) | 存活组(n=57) | Z/χ2值 | P值 |
| 尿量(mL/h) | 49.0(25.0, 115.0) | 46.0(25.0, 106.0) | 50.0(25.5, 120.0) | 0.637 | 0.524 |
| 乳酸(mmo/L) | 1.4(1.0, 2.2) | 1.5(1.0, 2.5) | 1.3(1.1, 1.8) | 0.747 | 0.455 |
| 肌钙蛋白(mmo/L) | 0.1(0.0, 0.3) | 0.1(0.0, 0.6) | 0.1(0.0, 0.2) | 0.407 | 0.684 |
| 尿素(mmo/L) | 11.3(6.3, 19.2) | 12.9(6.8, 19.8) | 11.2(5.3, 15.7) | 1.893 | 0.058 |
| 肌酐(umo/L) | 102.0(66.7, 159.0) | 111.0(72.1, 172.5) | 80.3(59.5, 137.5) | 1.984 | 0.047 |
| 血糖(mmo/L) | 7.0(5.5, 9.0) | 6.8(5.5, 9.1) | 7.3(5.5, 8.7) | 0.046 | 0.963 |
| 降钙素原(μg/L) | 0.9(0.3, 3.5) | 0.8(0.3, 3.1) | 1.0(0.3, 3.6) | 0.272 | 0.786 |
| CRP(ng/L) | 151.5(72.7, 226.0) | 155.0(86.8, 228.2) | 130.0(56.9, 223.8) | 0.69 | 0.490 |
| LDH(U/L) | 280.0(216.5, 414.5) | 291.0(227.0, 420.0) | 263.0(209.8, 390.8) | 0.658 | 0.511 |
| AST(U/L) | 32.0(19.0, 69.0) | 30.0(18.0, 64.0) | 36.0(21.5, 88.0) | 1.207 | 0.228 |
| 总胆红素(mmol/L) | 10.0(6.0, 14.0) | 10.0(7.0, 14.5) | 8.0(6.0, 11.2) | 1.237 | 0.216 |
| 白细胞(×109/L) | 10.5(7.0, 14.2) | 9.6(6.6, 14.4) | 10.8(8.7, 13.8) | 1.517 | 0.129 |
| HCT(%) | 34.5(29.8, 40.5) | 33.8(29.5, 40.2) | 36.8(30.9, 41.0) | 1.096 | 0.273 |
| PLT(×109/L) | 199.0(155.0, 269.0) | 184.0(144.2, 247.5) | 217.0(169.0, 307.5) | 2.495 | 0.013 |
| APACHE-Ⅱ评分(分) | 45.0(38.0, 64.0) | 44.0(39.5, 66.0) | 46.0(36.0, 55.5) | 1.402 | 0.161 |
| ICU住院时间(d) | 6.0(4.0, 11.0) | 7.0(4.0, 12.5) | 6.0(4.0, 10.0) | 0.842 | 0.400 |
| 住院时间(d) | 15.5(9.8, 23.0) | 15.0(9.0, 24.0) | 16.0(10.0, 23.0) | 0.405 | 0.685 |
| 年龄(岁) | 70.0(62.8, 79.2) | 73.0(64.5, 81.0) | 68.0(57.5, 76.5) | 2.512 | 0.012 |
| BMI(kg/m2) | 26.7(22.7, 31.1) | 26.1(22.6, 30.8) | 27.6(23.0, 31.6) | 1.045 | 0.296 |
| 感染类别(n, %) | 2.473 | 0.480 | |||
| 病毒感染 | 37(27.6) | 21(27.3) | 16(28.1) | ||
| 病因不明 | 67(50.0) | 36(46.8) | 31(54.4) | ||
| 混合感染 | 11(8.2) | 6(7.8) | 5(8.8) | ||
| 细菌感染 | 19(14.2) | 14(18.2) | 5(8.8) | ||
| 性别(n, %) | 3.063 | 0.080 | |||
| 女 | 52(38.8) | 25(32.5) | 27(47.4) | ||
| 男 | 82(61.2) | 52(67.5) | 30(52.6) | ||
| 慢性心力衰竭(n, %) | 8.867 | 0.003 | |||
| 否 | 103(76.9) | 52(67.5) | 51(89.5) | ||
| 是 | 31(23.1) | 25(32.5) | 6(10.5) | ||
| ICU侵入通气(n, %) | 3.619 | 0.057 | |||
| 否 | 89(66.4) | 46(59.7) | 43(75.4) | ||
| 是 | 45(33.6) | 31(40.3) | 14(24.6) | ||
| ICU住院期间ARDS(n, %) | 4.206 | 0.040 | |||
| 否 | 118(88.1) | 64(83.1) | 54(94.7) | ||
| 是 | 16(11.9) | 13(16.9) | 3(5.3) | ||
| ICU气管切开术(n, %) | 2.272 | 0.132 | |||
| 否 | 131(97.8) | 74(96.1) | 57(100.0) | ||
| 是 | 3(2.2) | 3(3.9) | 0(0.0) | ||
| ICU血管加压药(n, %) | 1.605 | 0.205 | |||
| 否 | 81(60.4) | 43(55.8) | 38(66.7) | ||
| 是 | 53(39.6) | 34(44.2) | 19(33.3) | ||
| ICU期间AKI(n, %) | 11.091 | <0.001 | |||
| 否 | 60(44.8) | 25(32.5) | 35(61.4) | ||
| 是 | 74(55.2) | 52(67.5) | 22(38.6) |
在入组的134例患者中,根据随访结果,其中位生存期34.5个月。入组ICU期间死亡16人,占比11.9%。住院期间死亡28人,占比20.8%。1月内死亡22人,占比16.4%。1年内死亡42人,占比31.3%。截止随访截止(随访4年)时间死亡77人,占比57.4%。
2.3 随访截止后COX回归对入组的134例患者,截止随访时间(随访4年),行COX回归分析,总胆红素、APACHE Ⅱ评分、年龄、BMI、感染细菌、合并慢性心力衰竭、ICU期间侵入通气、发生ARDS、给予血管加压药和发生AKI是影响重症肺炎死亡的危险因素。总胆红素、年龄、BMI和ICU期间AKI是影响重症肺炎死亡的独立危险因素(P<0.05),见表 2。
| 项目 | 单因素HR(95%CI) | P值 | 多因素HR(95%CI) | P值 |
| 尿量(mL/h) | 1.000(0.998, 1.001) | 0.787 | ||
| 乳酸(mmo/L) | 1.041(0.979, 1.107) | 0.196 | ||
| 肌钙蛋白(mmol/L) | 0.992(0.920, 1.069) | 0.826 | ||
| 尿素氮(mmol/L) | 1.004(0.987, 1.021) | 0.646 | ||
| 肌酐(μmol/L) | 1.000(0.999, 1.002) | 0.557 | ||
| 血糖(mmol/L) | 0.990(0.904, 1.084) | 0.826 | ||
| 降钙素原(ug/L) | 1.006(0.990, 1.023) | 0.480 | ||
| CRP(mg/L) | 1.001(0.999, 1.003) | 0.482 | ||
| LDH(U/L) | 1.000(1.000, 1.000) | 0.754 | ||
| AST(U/L) | 1.000(1.000, 1.000) | 0.775 | ||
| 总胆红素(mmol/L) | 1.012(1.006, 1.019) | <0.001 | 1.009(1.001, 1.018) | 0.022 |
| 白细胞(×109/L) | 0.982(0.946, 1.019) | 0.338 | ||
| HCT(%) | 0.988(0.957, 1.021) | 0.475 | ||
| PLT(×109/L) | 0.998(0.995, 1.001) | 0.125 | ||
| APACHE-Ⅱ评分(分) | 1.019(1.007, 1.031) | 0.002 | 0.999(0.981, 1.017) | 0.896 |
| ICU住院时间(d) | 1.012(0.999, 1.025) | 0.063 | ||
| 住院时间(d) | 1.003(0.998, 1.008) | 0.280 | ||
| 年龄(岁) | 1.029(1.010, 1.048) | 0.003 | 1.028(1.004, 1.052) | 0.023 |
| BMI(kg/m2) | 0.965(0.932, 1.000) | 0.047 | 0.931(0.891, 0.973) | 0.002 |
| 感染类型:病毒感染 | Ref | Reference | ||
| 病因不明 | 0.964(0.561, 1.655) | 0.893 | 0.755(0.418, 1.365) | 0.352 |
| 混合感染 | 0.822(0.331, 2.041) | 0.673 | 0.655(0.249, 1.720) | 0.391 |
| 细菌感染 | 2.151(1.090, 4.245) | 0.027 | 1.843(0.850, 3.996) | 0.121 |
| 性别:男 | 1.523(0.944, 2.457) | 0.085 | ||
| 合并慢性心力衰竭 | 2.108(1.306, 3.403) | 0.002 | 1.606(0.924, 2.790) | 0.093 |
| ICU侵入通气 | 1.951(1.232, 3.091) | 0.004 | 1.658(0.785, 3.500) | 0.185 |
| ICU住院期间ARDS | 2.824(1.545, 5.161) | <0.001 | 1.981(0.790, 4.972) | 0.145 |
| ICU气管切开术 | 2.228(0.699, 7.104) | 0.176 | ||
| ICU血管加压药 | 1.752(1.113, 2.757) | 0.015 | 0.895(0.467, 1.714) | 0.737 |
| ICU期间AKI | 2.134(1.322, 3.444) | 0.002 | 1.781(1.003, 3.165) | 0.049 |
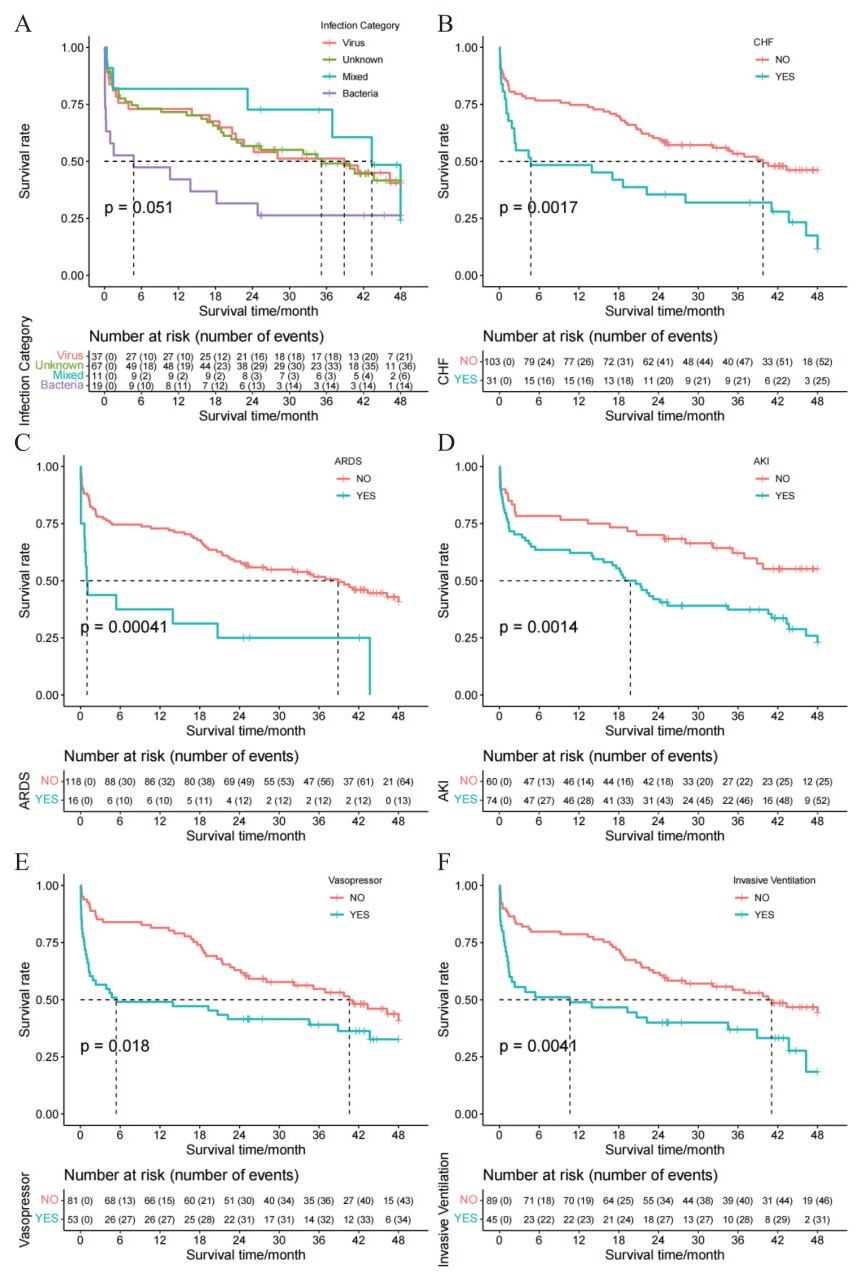
截止随访,对影响重症肺炎生存的分类变量进行生存曲线绘制,显示感染细菌、合并慢性心力衰竭、ICU期间侵入通气、发生ARDS、给予血管加压药和发生AKI的患者生存时间较短(P<0.05),见图 1。
|
| 注:Infection Category,感染类型;Virus,病毒感染;Unknown,未知感染;Mixed,混合感染;Bacteria,细菌感染;CHF,慢性心力衰竭;ARDS:急性呼吸窘迫综合征;AKI:急性肾损伤;Vasopressor,使用血管加压药;Invasive Ventilation,侵入性通气 图 1 重症肺炎患者截止随访时间的生存曲线 Fig 1 Survival Curve of Severe Pneumonia Patients at the End of Follow-up |
|
|
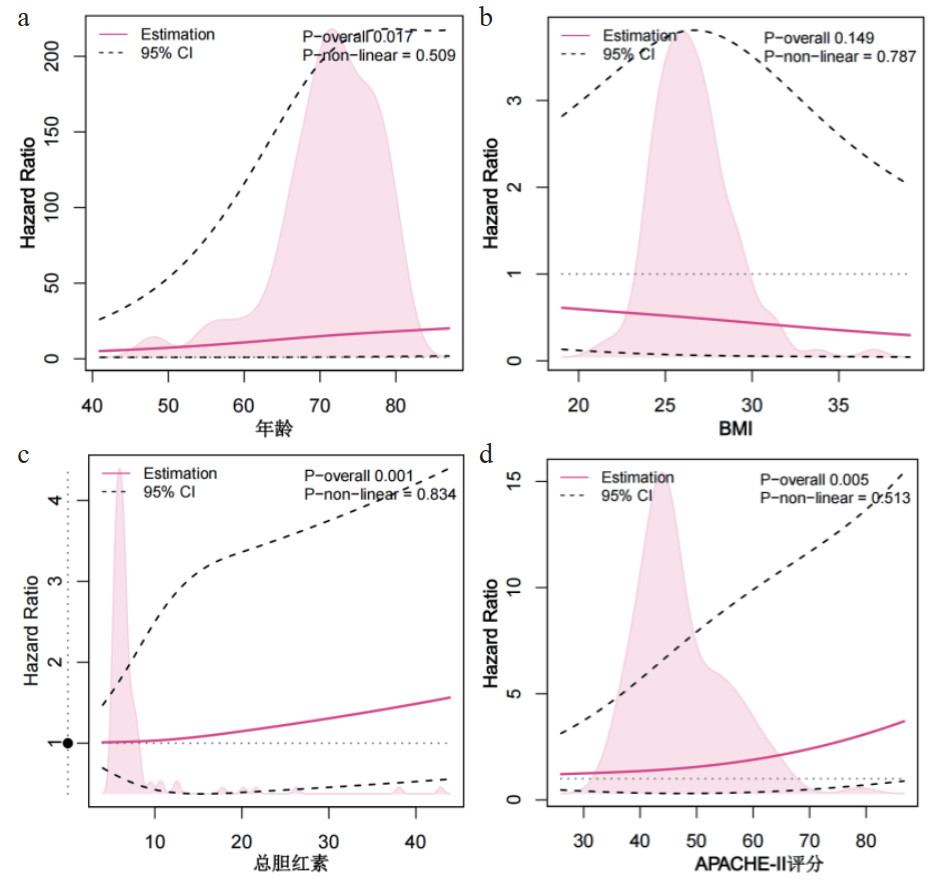
对影响重症肺炎生存的连续性变量进行限制性立方样条图绘制,年龄、总胆红素和APACHE-Ⅱ评分是其危险因素。BMI是其保护性因素,见图 2。
|
| 注:限制性立方样条图是一种用于数据分析和建模的非线性回归技术,它通过使用分段多项式函数来拟合数据,用来捕捉变量间的复杂非线性关系。随着年龄、总胆红素和APACHE-Ⅱ评分的增加,影响重症肺炎死亡的HR(危险比)逐渐上升,随着BMI的增加,HR逐渐下降 图 2 重症肺炎患者连续性影响因素的限制性立方样条图构建 Fig 2 Construction of restricted cubic spline plot for continuous influencing factors in severe pneumonia patients |
|
|
ICU期间死亡16例,占比11.9%。以患者是否在ICU期间死亡为因变量,以上述10种危险因素为自变量进行Logistic回归分析,提示总胆红素、APACHE-Ⅱ评分、ICU期间侵入通气、ICU期间发生ARDS和给予血管加压药是影响其死亡的危险因素(P<0.05),见表 3。
| 项目 | 单因素逻辑回归 | 多因素逻辑回归 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| 总胆红素 | 1.029(1.008, 1.051) | 0.006 | 1.025(0.997, 1.053) | 0.080 |
| APACHE-Ⅱ评分 | 1.041(1.015, 1.068) | 0.002 | 1.002(0.967, 1.039) | 0.898 |
| 年龄 | 1.038(0.989, 1.089) | 0.135 | ||
| BMI | 0.909(0.826, 1.001) | 0.051 | ||
| 感染类别:病毒感染 | Ref | |||
| 病因不明 | 0.406(0.102, 1.618) | 0.202 | ||
| 混合感染 | 0.640(0.067, 6.142) | 0.699 | ||
| 细菌感染 | 2.954(0.765, 11.401) | 0.116 | ||
| 合并慢性心力衰竭 | 2.232(0.740, 6.734) | 0.154 | ||
| ICU侵入通气 | 7.727(2.326, 25.676) | <0.001 | 1.258(0.248, 6.384) | 0.782 |
| ICU住院期间ARDS | 6.480(1.948, 21.552) | 0.002 | 1.490(0.309, 7.187) | 0.620 |
| ICU血管加压药 | 14.179(3.069, 65.513) | <0.001 | 7.881(1.134, 54.784) | 0.037 |
| ICU期间AKI | 2.710(0.826, 8.888) | 0.100 | ||
住院期间死亡28例,占比20.8%。以患者是否在住院期间死亡为因变量,总胆红素、APACHE-Ⅱ评分、ICU期间侵入通气、ICU期间发生ARDS和给予血管加压药亦是影响其死亡的危险因素(P<0.05),见表 4。
| 项目 | 单因素逻辑回归 | 多因素逻辑回归 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| 总胆红素 | 1.023(1.004, 1.042) | 0.020 | 1.020(0.995, 1.046) | 0.122 |
| APACHE-Ⅱ评分 | 1.031(1.009, 1.053) | 0.005 | 0.995(0.965, 1.026) | 0.749 |
| 年龄 | 1.018(0.984, 1.052) | 0.299 | ||
| BMI | 0.931(0.864, 1.002) | 0.057 | ||
| 感染类别:病毒感染 | Ref | |||
| 病因不明 | 0.935(0.333, 2.627) | 0.899 | ||
| 混合感染 | 0.429(0.047, 3.922) | 0.453 | ||
| 细菌感染 | 3.117(0.913, 10.635) | 0.069 | ||
| 合并慢性心力衰竭 | 2.249(0.906, 5.579) | 0.080 | ||
| ICU侵入通气 | 4.305(1.799, 10.304) | 0.001 | 0.575(0.148, 2.230) | 0.424 |
| ICU住院期间ARDS | 6.699(2.223, 20.186) | <0.001 | 2.134(0.513, 8.882) | 0.298 |
| ICU血管加压药 | 8.871(3.280, 23.994) | <0.001 | 8.845(2.094, 37.362) | 0.003 |
| ICU期间AKI | 1.607(0.679, 3.805) | 0.281 | ||
1个月内死亡22例,占比16.4%。以患者是否在1个月内死亡为因变量,总胆红素、APACHE-Ⅱ评分、ICU期间侵入通气、ICU期间发生ARDS、ICU期间给予血管加压药和细菌感染影响其死亡的危险因素(P<0.05),见表 5。BMI是其保护性因素(P<0.05)。
| 项目 | 单因素逻辑回归 | 多因素逻辑回归 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| 总胆红素 | 1.027(1.006, 1.048) | 0.011 | 1.024(0.990, 1.059) | 0.176 |
| APACHE-Ⅱ评分 | 1.032(1.009, 1.056) | 0.006 | 1.000(0.963, 1.039) | 0.991 |
| 年龄 | 1.028(0.989, 1.070) | 0.165 | ||
| BMI | 0.905(0.830, 0.987) | 0.025 | 0.865(0.774, 0.966) | 0.010 |
| 感染类别:病毒感染 | Ref | Ref | ||
| 病因不明 | 0.603(0.186, 1.949) | 0.398 | 0.383(0.094, 1.562) | 0.181 |
| 混合感染 | 0.517(0.055, 4.821) | 0.562 | 0.324(0.025, 4.114) | 0.385 |
| 细菌感染 | 3.758(1.063, 13.279) | 0.040 | 1.450(0.273, 7.693) | 0.663 |
| 慢性心力衰竭 | 1.711(0.627, 4.671) | 0.295 | ||
| ICU侵入通气 | 3.611(1.406, 9.278) | 0.008 | 0.474(0.090, 2.506) | 0.380 |
| ICU住院期间ARDS | 7.429(2.405, 22.944) | <0.001 | 4.315(0.575, 32.382) | 0.155 |
| ICU血管加压药 | 7.178(2.454, 20.991) | <0.001 | 5.680(1.167, 27.640) | 0.031 |
| ICU期间AKI | 1.925(0.729, 5.082) | 0.186 | ||
1个月内死亡42例,占比31.3%。以患者是否在1年内死亡为因变量,总胆红素、APACHE-Ⅱ评分、ICU期间侵入通气、ICU期间发生ARDS、ICU期间给予血管加压药、细菌感染、年龄和合并慢性心力衰竭是影响其死亡的危险因素(P<0.05),见表 6。BMI是其保护性因素(P<0.05)。
| 项目 | 单因素逻辑回归 | 多因素逻辑回归 | ||
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| 总胆红素 | 1.019(1.000, 1.037) | 0.050 | ||
| APACHE-Ⅱ评分 | 1.041(1.019, 1.063) | <0.001 | 1.011(0.978, 1.044) | 0.518 |
| 年龄 | 1.037(1.004, 1.070) | 0.028 | 1.040(0.996, 1.085) | 0.074 |
| BMI | 0.929(0.871, 0.991) | 0.025 | 0.896(0.825, 0.972) | 0.008 |
| 感染类别:病毒感染 | Ref | Ref | ||
| 病因不明 | 1.069(0.435, 2.627) | 0.885 | 0.778(0.274, 2.204) | 0.636 |
| 混合感染 | 0.600(0.110, 3.269) | 0.555 | 0.356(0.045, 2.840) | 0.330 |
| 细菌感染 | 3.712(1.159, 11.895) | 0.027 | 2.784(0.627, 12.352) | 0.178 |
| 合并慢性心力衰竭 | 3.159(1.373, 7.266) | 0.007 | 2.736(0.940, 7.961) | 0.065 |
| ICU侵入通气 | 3.852(1.777, 8.350) | <0.001 | 1.972(0.496, 7.847) | 0.335 |
| ICU住院期间ARDS | 4.479(1.505, 13.329) | 0.007 | 2.091(0.414, 10.574) | 0.372 |
| ICU血管加压药 | 4.569(2.100, 9.942) | <0.001 | 1.765(0.503, 6.189) | 0.375 |
| ICU期间AKI | 2.000(0.935, 4.279) | 0.074 | ||
重症肺炎患者的病死率在随时间的推移中逐步增加,特别是在ICU和住院期间,患者的死亡风险较大,随着病程的延续,死亡的累积风险逐渐加重。本中心分析134例重症肺炎患者的死亡危险因素,随着时间延长,影响重症肺炎患者死亡的因素发生了动态变化。
ICU及住院期间,总胆红素水平、APACHE-Ⅱ评分、是否需要机械通气、是否发生ARDS和是否使用血管加压药是与死亡风险密切相关的因素。胆红素是肝脏代谢的主要成分,当肝功能受到损害时,胆红素的代谢和排泄受阻,导致血液中胆红素水平升高。重症肺炎患者出现肝功能损害时,意味着患者的多脏器功能已经受到影响,提示预后较差[8]。APACHE-Ⅱ通过综合评估患者的生命体征、病理生理状态、实验室检查结果等多个维度,能够准确反映患者的病情严重程度。高APACHE-Ⅱ评分通常意味着患者的临床状况较差[9]。侵入性机械通气的需要反映了患者的呼吸衰竭程度,对于重症肺炎患者来说,呼吸衰竭是常见的致命并发症之一。当患者的肺功能无法维持正常的气体交换时,机械通气成为支撑生命的重要手段。需要机械通气的患者通常意味着病情较为严重,呼吸衰竭可能是导致死亡的重要原因[10]。ARDS的发生则是指肺部损伤严重,导致肺泡和毛细血管的通透性增高,进而引起严重的气体交换障碍。ARDS不仅加剧了患者的呼吸困难,还可能导致低氧血症、肺部感染等一系列并发症,进一步加重患者的病情。血管加压药的使用通常是循证医学中对严重循环衰竭的指示,表明患者的循环系统可能处于危机状态。血管加压药用于维持血压和灌注,但其使用也表明患者的基础代谢状态已严重紊乱。长期依赖血管加压药可能导致多脏器衰竭,增加死亡风险。
1个月内死亡的患者中,细菌感染是新增的死亡危险因素。细菌感染在急性肺炎患者中尤为常见,且可能导致脓毒症等严重并发症,进一步加重患者的病情[11]。对于重症肺炎患者,细菌感染不仅加剧了肺部损伤,还可导致全身性炎症反应,增加死亡风险[12]。研究中细菌感染的影响突显了早期诊断和及时抗生素治疗在降低短期病死率中的重要性[13-14]。BMI在重症肺炎患者的生存中起到了保护性作用。回归分析显示,BMI与死亡风险显著相关。适中的BMI有助于保持良好的营养状态和免疫功能,进而减少死亡风险。体重过轻可能导致免疫功能下降,增加感染风险,而体重过重则可能引起慢性炎症反应,增加心血管负担。因此,保持适度的BMI对于重症肺炎患者的康复至关重要。
1年内死亡的患者中,年龄和慢性心力衰竭是显著的影响因素。年龄增大通常伴随着免疫功能下降、并发症增加等问题,使得老年患者在感染和治疗过程中面临更高风险。慢性心力衰竭患者由于心脏功能本身的不足,其对感染和重症肺炎的耐受性较差,且心脏病与肺部疾病的相互影响可能加剧病情的恶化。因此,年龄和慢性心力衰竭是预测重症肺炎患者长期死亡的关键因素。
随访数据显示,AKI成为影响死亡的重要因素。尽管AKI通常在ICU期间发生,但其长期影响同样显著。在重症肺炎的后期,AKI与长期的全身炎症反应、器官功能逐步衰竭及治疗不当等因素相关。肾功能衰竭会通过全身炎症反应影响心脏、肺部等器官,加重病情。随着随访时间的延长,AKI的影响愈加明显,提示其在多器官衰竭中的重要作用。因此,临床上应加强对AKI患者的多器官监测与干预。随着病情的延续,AKI会加剧患者的身体负担,导致肾功能无法有效恢复,进而影响其他器官的功能,尤其是在已经存在其他并发症的情况下,AKI的发生会加剧死亡风险。因此,在随访期内,AKI的出现不仅反映了重症肺炎患者的预后不良,还可能是器官衰竭恶化的警示信号,提示其对长期生存的影响非常关键。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周文考:文章撰写、整理和提交;苏力德,统计分析;黄灵炎、郭爱林和潘艺梅:数据整理;刘宗泓、姚亚奔:研究指导、论文修改、经费支持
| [1] | Calabretta D, Martìn-Loeches I, Torres A. New guidelines for severe community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2024, 45(2): 274-286. DOI:10.1055/s-0043-1777797 |
| [2] | Cavallazzi R, Ramirez JA. Definition, epidemiology, and pathogenesis of severe community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2024, 45(2): 143-157. DOI:10.1055/s-0044-1779016 |
| [3] | Niederman MS, Torres A. Severe community-acquired pneumonia[J]. Eur Respir Rev, 2022, 31(166): 220123. DOI:10.1183/16000617.0123-2022 |
| [4] | 李雪, 吴嘉荔, 马汉宁, 等. 不同评分对重症肺炎合并急性呼吸窘迫综合征预后模型的建立与评价[J]. 中华急诊医学杂志, 2023, 32(8): 1039-1045. DOI:10.3760/cma.j.issn.1671-0282.2023.08.006 |
| [5] | Salluh JIF, Póvoa P, Beane A, et al. Challenges for a broad international implementation of the current severe community-acquired pneumonia guidelines[J]. Intensive Care Med, 2024, 50(4): 526-538. DOI:10.1007/s00134-024-07381-z |
| [6] | Carella F, Aliberti S, Stainer A, et al. Long-term outcomes in severe community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2024, 45(2): 266-273. DOI:10.1055/s-0044-1781426 |
| [7] | 中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [8] | Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [9] | Long ME, Mallampalli RK, Horowitz JC. Pathogenesis of pneumonia and acute lung injury[J]. Clin Sci (Lond), 2022, 136(10): 747-769. DOI:10.1042/CS20210879 |
| [10] | Sakakibara T, Shindo Y, Kobayashi D, et al. A prediction rule for severe adverse events in all inpatients with community-acquired pneumonia: a multicenter observational study[J]. BMC Pulm Med, 2022, 22(1): 34. DOI:10.1186/s12890-022-01819-0 |
| [11] | 刘丽红, 屈满英, 刘莹, 等. 成人重症肺炎临床特征及病原学分析[J]. 中华急诊医学杂志, 2022, 31(11): 1521-1525. DOI:10.3760/cma.j.issn.1671-0282.2022.11.015 |
| [12] | Campaña-Duel E, Camprubí-Rimblas M, Areny-Balagueró A, et al. Risk of multidrug-resistant pathogens in severe community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2024, 45(2): 246-254. DOI:10.1055/s-0043-1778138 |
| [13] | Bassetti M, Giacobbe DR, Magnasco L, et al. Antibiotic strategies for severe community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2024, 45(2): 187-199. DOI:10.1055/s-0043-1778641 |
| [14] | Robertson J, Adiels M, Lissner L, et al. BMI in early adulthood is associated with severe COVID-19 later in life: a prospective cohort study of 1.5 million Swedish men[J]. Obesity (Silver Spring), 2022, 30(3): 779-787. DOI:10.1002/oby.23378 |
 2025, Vol. 34
2025, Vol. 34