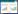以肾功能突然下降为特征的急性肾损伤(acute kidney injury, AKI)是危重患者的常见疾病之一,它与住院病死率和不良结局增加相关[1-4]。在既往有肾功能障碍(preexisting kidney dysfunction,PKD)基础上发生的AKI,在重症监护室患者中也尤为普遍[5-7]。有研究指出,与既往没有肾功能障碍的患者相比,PKD患者发生AKI的长期生存率显著降低,透析风险也更高[7]。到目前为止,大多数的研究包括改善全球肾脏病预后(kidney disease:improving global outcomes, KDIGO)的AKI诊断标准均使用7 d内血清肌酐(serum creatinine,SCr)比基线增加≥50%来诊断PKD患者的AKI。然而,这些标准在PKD患者中的有效性尚未得到充分评估。由于PKD患者需要显著增加的SCr值才能满足KDIGO的AKI诊断标准, 而SCr即使小幅度的增加也与不良预后有关[8-9]。因此,根据KDIGO或类似的AKI诊断标准可能会遗漏PKD患者发生的AKI。针对KDIGO标准诊断PKD患者AKI的缺陷,Xu等[10]提出了一种基于SCr参考值变化(reference change value, RCV)的标准来定义PKD的AKI即慢性肾脏病患者血清肌酐参考值变化的急性肾损伤(creatinine reference change value optimized criteria for AKI in adult with CKD,cROCK)标准。此外,笔者前期在KDIGO指南的基础上,基于重症医学数据库(medical information mart for intensive care,MIMIC-Ⅳ)建立了一种PKD患者AKI诊断和分期的新系统称为既往肾功能障碍急性加重(acute on pre-existing kidney dysfunction, APKD)[11]。尽管已经有研究关注了PKD患者发生AKI的特殊性,也建立了一些新的诊断和分期系统。然而,APKD与既往的KDIGO、cROCK诊断分期标准在PKD患者中的应用价值未得到充分比较。本研究旨在比较KDIGO、cROCK和APKD标准对PKD患者AKI的诊断、分期和预测预后能力的差异,为临床PKD患者AKI的诊断分期标准的选择提供参考依据。
1 资料与方法 1.1 研究对象本研究选择温州医科大学附属第一医院监护室2020年10月1日至2022年10月1日期间收治的患者为研究对象。本研究按照《赫尔辛基宣言》进行,经本院伦理委员会审核批准(KY2024-R126),相关医疗数据的分析使用已获研究对象或其亲属同意。纳入标准:①年龄≥18岁;②住ICU时长≥24 h;③入院期间血清肌酐测量值≥2次④肾小球滤过率(glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2)。排除标准:①年龄小于18岁;②住ICU时长 < 24 h;③入院期间血清肌酐测量值< 2次且无法定义基线肌酐的;④eGFR≥60 mL/(min·1.73 m2);⑤出院诊断为终末期肾病患者或依赖肾脏替代治疗患者;⑥出院诊断接受过肾移植患者。
1.2 研究方法本研究回顾性的收集了温州医科大学附属第一医院住院病例系统中重症监护室患者的如下信息:①基本信息:性别、年龄;②既往基础疾病:高血压、冠心病、糖尿病、慢性肺疾病、慢性肝病、肿瘤等;③临床干预:入监护室24 h内是否使用血管活性药物(包括去甲肾上腺素、多巴胺等)以及入监护室后是否接受肾脏替代治疗;③住院系统中所有的肌酐测量值;④评分:急性生理和慢性健康评分Ⅱ(acute physiology and chronic health evaluation-Ⅱ,APACHE-Ⅱ);⑤患者出院前病情转归情况。以住院病死率为本研究结局,院内宣布死亡或放弃治疗自动出院均定义为住院死亡。
1.3 定义本研究使用动态基线肌酐作为基线肌酐值,动态基线肌酐定义为在48 h或7 d诊断时间窗内肌酐测量的最小值[12]。AKI的诊断和分期根据住院期间肌酐测量值的最大值较基线肌酐的变化来判断。肾小球滤过率(GFR)是基于基线肌酐的MDRD(modification of diet in renal disease equation)公式估算得到。同时,将既往肾功能障碍(PKD)定义为基于基线肌酐计算的eGFR < 60 mL/(min·1.73 m2)。本研究采用3个AKI诊断标准,包括KDIGO标准、cROCK标准和APKD标准。KDIGO标准将AKI定义为48 h内肌酐增加0.3 mg/dL,或7 d内肌酐较基线增加1.5倍[13]。cROCK标准将AKI定义为7d内肌酐较基线升高25%[10]。APKD标准将AKI定义为48 h内肌酐绝对升高0.2 mg/dL或7 d内肌酐升高超过基线的1.1倍[11]。另外本研究中使用了两个AKI分期标准,KDIGO标准的AKI2期定义为7 d内峰值肌酐与基线比值为2.0~2.9。肌酐增加至基线的3倍,或肌酐值超过4.0 mg/dL,或接受肾脏替代治疗被归类为AKI 3期[10]。APKD标准将AKI 2期和AKI 3期分别定义为肌酐较基线增加1.3倍和1.9倍。
1.4 统计学方法本研究的统计分析通过IBM SPSS (statistical product and service solutions) 26.0 (IBM, Armonk, NY, USA) 与R软件(4.2.2) 实现,所有统计测试都是双侧的,P值< 0.05被认为具有统计学意义。经正态性检验所有连续变量均不符合正态分布,以中位数(四分位数)[M(Q1, Q3)] 表示。分类变量表示为频数和百分比。组间连续变量的比较采用Mann-Whitney检验,分类变量比较采用χ2检验或Fishers精确检验。使用R软件pROC包绘制ROC曲线分析三种诊断分期标准预测PKD患者预后的价值。通过使用Youden指数确定了预测住院病死率的最佳阈值。基于该阈值点计算并比较了受试者工作特征曲线下面积(area under curve,AUC)和分期标准的敏感度。Logistic回归用于分析患者院内死亡风险并计算比值比(odds ratio,OR)和95%置信区间
2 结果 2.1 一般资料在回顾了2020年10月1日至2022年10月1日期间监护室收治的1 659例患者后,按照纳入和排除标准,最后共570例PKD患者被纳入本研究(图 1)。患者的中位年龄为72岁,男性患者有358名(62.8%),RRT使用率为43.7%(表 1)。根据APKD、KDIGO和cROCK标准在PKD患者中AKI的诊断情况,将PKD患者分为3组。其中APKD标准诊断的AKI患者460名(80.7%),KDIGO标准诊断的AKI患者376名(66.0%),cROCK标准诊断的AKI患者268名(47.0%)。发现KDIGO标准诊断的AKI患者较APKD诊断的AKI患者基线肌酐更高(193.0 μmol/L vs. 186.0 μmol/L,P=0.478),而cROCK标准诊断的AKI患者基线肌酐显著低于APKD诊断的AKI患者(169.5 μmol/L vs. 186.0 μmol/L,P=0.007)。
|
| 图 1 纳入排除患者流程图 Fig 1 Flow chart of the included patients |
|
|
| 基线特征 | 所有患者 | APKD AKI | KDIGO AKI | cROCK AKI |
| 患者人数(n) | 570 | 460 | 376 | 268 |
| 年龄(岁)a | 72.0 [62.0, 79.0] | 72.0[62.0, 79.0] | 71.0 [62.0, 78.0] | 71.0 [63.0, 78.0] |
| 性别,男性(n, %) | 358 (62.8) | 291 (63.3) | 245 (65.2) | 173 (64.6) |
| 基线肌酐(μmol/L)a | 183.0 [132.0, 319.2] | 186.0 [131.8, 326.5] | 193.0 [137.0, 344.0] | 169.5 [126.0, 253.5] |
| 峰值肌酐(μmol/L)a | 266.5 [176.0, 449.2] | 286.0[191.0, 473.8] | 313.0 [217.8, 492.8] | 289.5 [203.0, 476.2] |
| eGFR[mL/(min·1.73 m2)]a | 31.7 [16.2, 46.0] | 31.7 [15.8, 46.0] | 29.7 [15.1, 41.1] | 34.6 [21.4, 48.0] |
| APACHE-Ⅱ评分a | 15.0 [11.0, 20.0] | 15.0 [11.0, 20.0] | 15.0 [11.0, 20.0] | 15.0 [11.0, 19.2] |
| 基础疾病(n, %) | ||||
| 高血压 | 321 (56.3) | 259 (56.3) | 212 (56.4) | 146 (54.5) |
| 冠心病 | 115 (20.2) | 95 (20.7) | 83 (22.1) | 61 (22.8) |
| 心力衰竭 | 87 (15.3) | 68 (14.8) | 57 (15.2) | 36 (13.4) |
| 慢性肺疾病 | 28 (4.9) | 22 (4.8) | 16 (4.3) | 13 (4.9) |
| 肝脏疾病 | 48 (8.4) | 36 (7.8) | 30 (8.0) | 19 (7.1) |
| 糖尿病 | 206 (36.1) | 165 (35.9) | 136 (36.2) | 97 (36.2) |
| 恶性肿瘤 | 56 (9.8) | 66 (14.3) | 39 (10.4) | 26 (9.7) |
| RRT | 249 (43.7) | 215 (46.8) | 188 (50.0) | 130 (48.5) |
| 注:a为M(Q1, Q3) | ||||
基于APKD、KDIGO和cROCK标准的PKD患者AKI的诊断率分别为460(80.7%),376(66.0%)和268(47.0%),APKD标准较KDIGO和cROCK标准的AKI诊断率更高(80.7% vs. 66.0%,P < 0.001;80.7% vs. 47.0%,P < 0.001)。但APKD与KDIGO和cROCK之间的AKI相关病死率差异无统计学意义(32.4% vs. 33.0%,P=0.857;32.4% vs. 33.6%,P=0.872), 见表 2。
| AKI诊断标准 | AKI识别率 | NOAKI病死率 | AKI病死率 |
| KDIGO | 376 (66.0) | 36 (18.6) | 124 (33.0) |
| cROCK | 268 (47.0) | 70 (23.2) | 90 (33.6) |
| APKD | 460 (80.7) | 11 (10.0) | 149 (32.4) |
与KDIGO和cROCK标准相比, APKD识别的AKI患者多出84例(14.7%)和192例(19.6%),且AKPD识别但被KDIGO或cROCK漏诊的患者病死率显著高于NO AKI患者(29.8% vs. 10.0%,P<0.001;30.7% vs. 10.0%,P<0.001)。Logistic回归也提示这些漏诊患者较NOAKI患者不良预后的优势比显著增加(OR=5.18, 95% CI: 2.15~13.67和OR=4.58, 95% CI: 2.26~10.14)见表 3。
| 指标 | NO AKI | APKD AKI | KDIGO漏诊AKI | cROCK漏诊AKI |
| 患者人数 | 110 | 460 | 84 | 192 |
| 病死率(n, %) | 11 (10.0) | 149 (32.4) | 25 (29.8) | 59 (30.7) |
| 调整后OR值 | Ref | 4.95(2.61 ~ 10.33) | 5.18 (2.15 ~ 13.67) | 4.58 (2.26 ~ 10.14) |
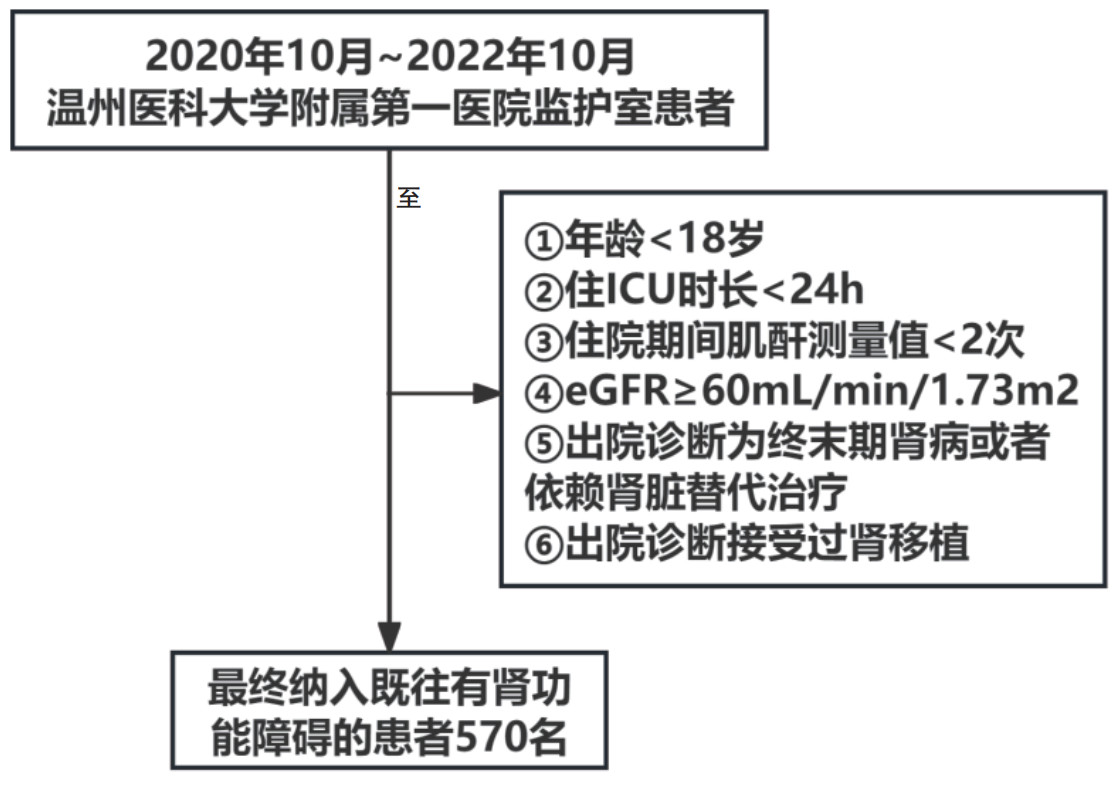
ROC曲线分析显示,APKD诊断标准在预测PKD患者住院病死率时的曲线下面积AUC值最大(AUC=0.736,95% CI 0.691~0.781)(图 2)。然后使用约登指数的最大值(敏感度+特异度-1)作为选择最佳截断值的标准,APKD诊断标准在预测住院病死率的敏感度上也显著高于KDIGO和cROCK标准(0.738 vs. 0.663,P < 0.001;0.738 vs. 0.613,P < 0.001),见表 4。
|
| 图 2 APKD、KDIGO和cROCK诊断标准预测PKD患者预后的ROC曲线 Fig 2 ROC curves of APKD, KDIGO, and cROCK diagnostic criteria for predicting prognosis in PKD patients |
|
|
| AKI诊断标准 | AUC值 | 95% CI | 敏感度 | 特异度 | 约登指数 |
| APKD | 0.736 | 0.691~0.781 | 0.738 | 0.634 | 0.372 |
| KDIGO | 0.714 | 0.667~0.762 | 0.663 | 0.693 | 0.356 |
| cROCK | 0.699 | 0.650~0.747 | 0.613 | 0.695 | 0.308 |
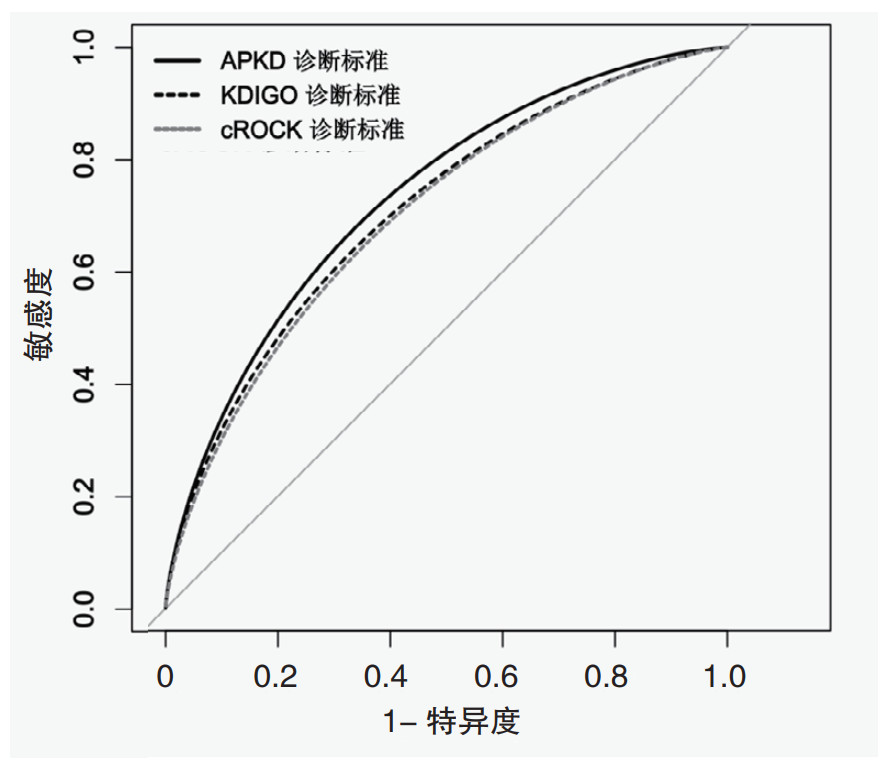
根据KDIGO标准,PKD患者的AKI2期识别率极低(1.1%),且NO AKI和AKI 1~3期的病死率分别为18.6%、27.3%、0.0%和37.0%, 住院病死率没有随着KDIGO分期的增加而增加。而根据APKD标准,NO AKI和AKI 1~3期的病死率分别为10.0%、19.7%、28.1%和40.9%。住院病死率随着APKD分期的增加而增加(图 3)。使用多变量Logistic回归模型探究APKD标准不同AKI分期与病死率关系,OR值也随着APKD分期的增加而增加(OR=2.34, 95% CI: 1.09~5.31; OR=4.50, 95% CI: 2.05~10.46; OR=7.03, 95% CI: 3.59~15.01)。
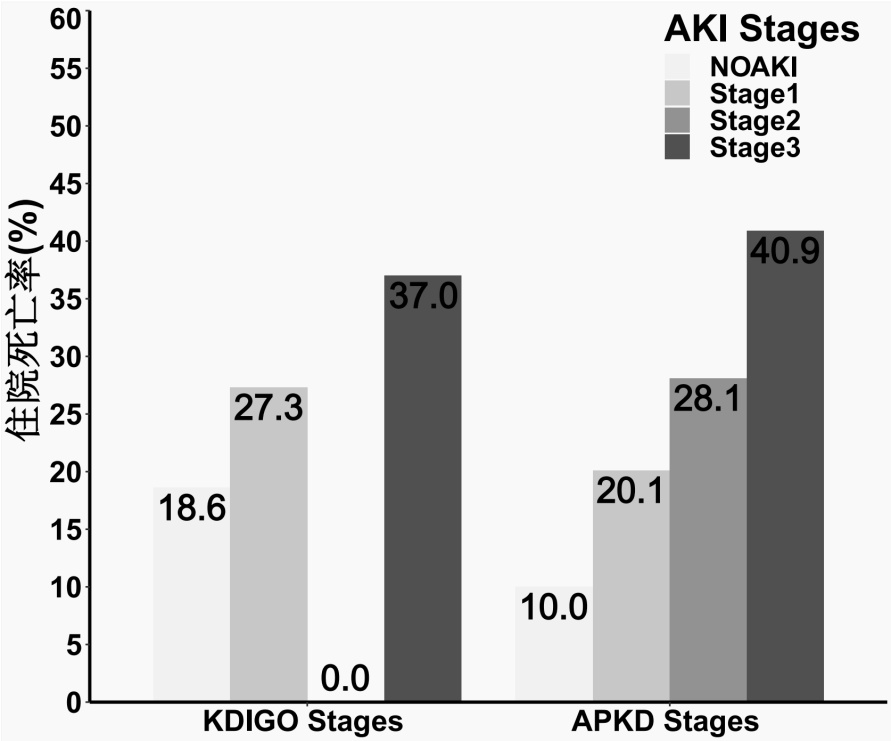
|
| 图 3 APKD和KDIGO分期标准不同AKI分期的住院病死率分布 Fig 3 Distribution of in-hospital mortality rates for different AKI stages based on APKD and KDIGO staging criteria |
|
|
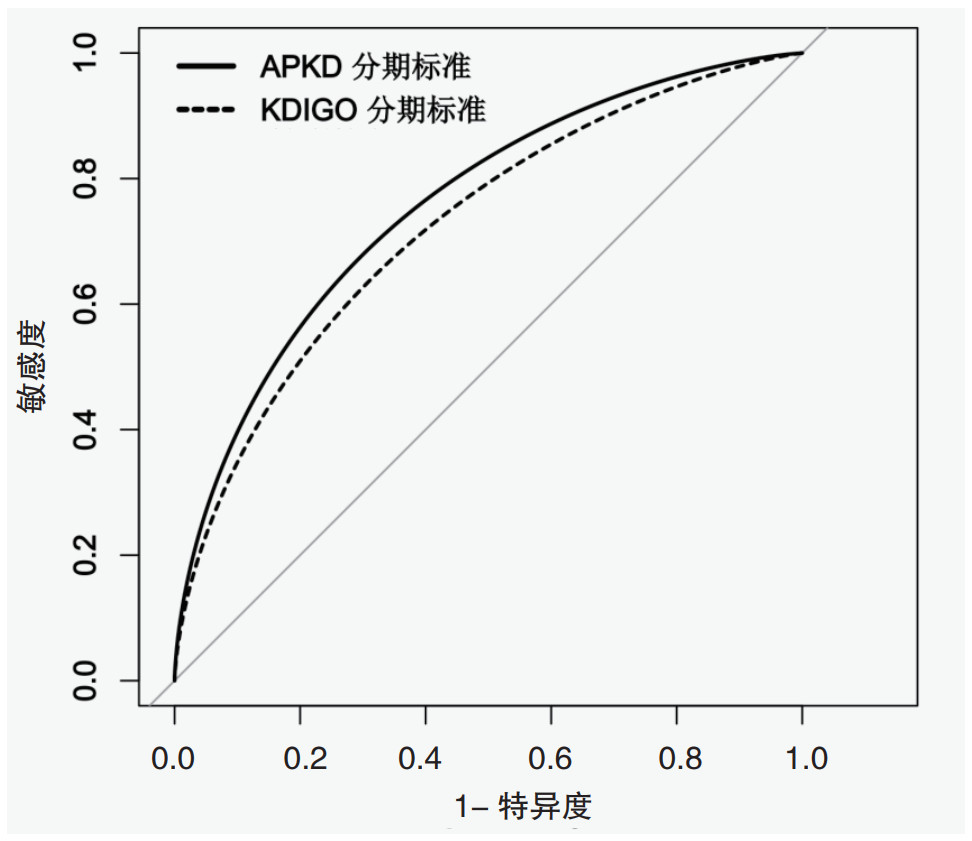
如图 4所示,APKD分期标准在预测PKD患者住院病死率时的曲线下面积AUC值显著高于KDIGO分期标准(AUC=0.756 vs. 0.724,P=0.02)。使用约登指数的最大值(敏感度+特异度-1)作为选择最佳截断值的标准,APKD分期标准在预测住院病死率的敏感度(0.675 vs. 0.650)和特异度(0.712 vs. 0.720)上与KDIGO分期标准相似。见表 6。
|
| 图 4 APKD和KDIGO分期标准预测PKD患者预后的ROC曲线 Fig 4 ROC curves for predicting prognosis of PKD patients using APKD and KDIGO staging criteria |
|
|
| AKI分期 | APKD分期标准 | KDIGO分期标准 | ||||
| 人数(n,%) | 病死率(%) | 调整后OR值 | 人数(n,%) | 病死率(%) | 调整后OR值 | |
| NOAKI | 110(19.3) | 10.0 | Reference | 194 (34.6) | 18.6 | Reference |
| Stage1 | 134 (23.5) | 19.7 | 2.39 ( 1.11 ~ 5.44 ) | 132 (23.2) | 27.3 | 1.68 ( 0.96 ~ 2.96 ) |
| Stage2 | 89 (15.6) | 28.1 | 4.33 ( 1.96 ~10.11 ) | 6 (1.1) | 0.0 | NA |
| Stage3 | 237 (41.6) | 40.9 | 7.71 ( 3.90 ~16.57 ) | 238 (41.8) | 37.0 | 3.05 ( 1.87 ~ 5.07 ) |
| AKI分期标准 | AUC值 | 95% CI | 敏感度 | 特异度 | 约登指数 |
| APKD | 0.756 | 0.713-0.800 | 0.675 | 0.712 | 0.387 |
| KDIGO | 0.724 | 0.677-0.771 | 0.650 | 0.720 | 0.370 |
AKI是住院患者的严重并发症之一,它与病死率和不良结局的增加相关,而慢性肾脏病(CKD)是一种患病率不断上升的常见疾病,越来越被认为是一个全球公共卫生问题,它不仅与糖尿病和高血压密切相关,也是AKI发生的主要危险因素[14-15]。有研究认为,基于12个月内基线SCr水平估算的肾小球滤过率(eGFR) < 60 mL/(min·1.73 m2)可以认为患有慢性肾脏病[16-18]。然而,在重症监护病房(ICU)的临床实践中,入院前的基线SCr,特别是入院前7~365 d的SCr水平,通常是无法获得的[19-20]。此外,作为诊断CKD的前提,肾功能不全的准确持续时间也难以确定。也就是说,eGFR降低的患者可能患有CKD、AKI或同时伴有CKD和AKI[4]。在本研究中纳入了入院时肾小球滤过率(eGFR) < 60 mL/(min·1.73 m2)患者作为研究对象,而不考虑其肾功能不全持续时间。针对这类既往肾功能障碍(PKD)的患者,如何早期发现AKI并对其严重程度进行分类对于改善他们的预后至关重要。
然而,当前的AKI标准,例如RIFLE、AKIN和KDIGO标准,主要基于没有预先存在肾功能障碍的全球参与者的数据制定的,因此这些标准往往受到患者基线肌酐水平的影响。研究表明,低基线肌酐患者血清肌酐的小幅度绝对值变化不如高基线肌酐患者相同比率的绝对值变化显著[24-25]。因此根据KDIGO、AKIN和RIFLE的AKI定义,基线肌酐低的患者小幅度的SCr值升高即可诊断为AKI, AKI发病率也明显更高。而基线肌酐高的患者(PKD)需要大幅度的SCr值升高才可诊断AKI。因此,这类患者如果按照传统的诊断标准将不可避免的存在AKI漏诊。针对传统的AKI诊断标准在既往肾功能障碍患者诊断方面的缺陷,Xu等[10]提出了一个基于SCr参考值变化(cROCK)的AKI诊断标准。该标准将既往肾功能障碍患者的AKI定义为7 d内SCr较基线增加≥25%。另外,笔者前期的一项研究是基于MIMIC-Ⅳ数据库中的危重症患者设计的,在KDIGO指南基础上,建立了一个既往肾功能障碍患者AKI诊断和分期的新系统称为APKD。该标准将PKD患者的AKI定义为48 h内SCr酐绝对升高0.2 mg/dL或7 d内SCr较基线增加1.1倍[11]。这两种针对PKD患者AKI发生而开发的新标准都降低了SCr较基线升高的阈值,理应较传统的诊断标准有更高的AKI识别率。然而,目前很少有研究比较这些标准和传统的AKI标准在PKD患者中的应用价值,例如AKI的检出率、AKI与预后的关联以及对预后的预测能力。
本研究中首次比较了APKD、cROCK标准和传统的KDIGO标准在PKD患者AKI发生的诊断、分期和预测预后能力方面的差异。首先,在AKI诊断方面,APKD诊断标准较KDIGO和cROCK标准的识别率更高。与KDIGO和cROCK诊断标准相比,由于APKD标准设置了较低的sCr水平增加阈值来诊断AKI,因此从理论上说APKD标准能识别更多的AKI患者。但与Sun等[26]研究中的结果不同的是,在本研究中,cROCK标准检测到的AKI事件反而较KDIGO更少(47.0% vs.66.0%)。通过对组间基线肌酐的比较,发现在本队列中,KDIGO标准漏诊的AKI患者较APKD诊断的AKI患者基线肌酐更低(142.0 μmol/L vs. 186.0 μmol/L),而cROCK标准漏诊的AKI患者基线肌酐显著高于APKD诊断的AKI患者(248.0 μmol/L vs. 186.0 μmol/L),因此对比cROCK标准将PKD患者的AKI定义为7 d内肌酐较基线升高25%,高基线肌酐的患者更容易满足KDIGO标准的48 h内肌酐绝对值升高26.5 μmol/L。接着,我们分析了KDIGO或cROCK标准漏诊的AKI患者与不良预后的相关性。结果提示AKPD识别但被KDIGO或cROCK标准漏诊的患者与住院病死率升高显著相关。这进一步体现APKD标准在PKD患者AKI诊断上的优势。同时,ROC曲线分析也提示,APKD较KDIGO和cROCK诊断标准在预测PKD患者住院病死率上有更好的准确性。
在进行了PKD患者AKI的诊断后,对不同危险程度的AKI患者进行分期也尤为重要[27-28]。本研究只比较了APKD分期标准和传统的KDIGO分期标准在PKD患者AKI分期和预测预后能力方面的差异。与先前针对MIMIC和eICU数据库的大型队列研究相似,本队列中也发现,根据KDIGO分期标准,PKD患者的AKI2期识别率极低(1.1%),且AKI1~AKI3期患者住院病死率并没有随着AKI分期的增加而增加(27.3%,0%,37.0%)。相反,根据APKD分期标准,AKI1~AKI3期患者的住院病死率分别为20.1%,28.1%,40.9%, 多因素Logistic回归也提示死亡风险OR值随着APKD分期的增加而增加。同时,APKD分期标准在预测PKD患者住院病死率时的曲线下面积AUC值也显著高于KDIGO分期标准。
利益冲突 所有作者声明无利益冲突
作者贡献声明 洪德江:研究设计、数据收集、数据分析、论文撰写;陈泽:数据收集、数据分析;赵光举:研究设计、论文修改、论文审阅、指导、定稿;罗江:研究设计、论文修改、论文审阅、数据收集、论文撰写
| [1] | Ronco C, Bellomo R, Kellum JA. Acute kidney injury[J]. Lancet, 2019, 394(10212): 1949-1964. DOI:10.1016/S0140-6736(19)32563-2 |
| [2] | Hoste EAJ, Bagshaw SM, Bellomo R, et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study[J]. Intensive Care Med, 2015, 41(8): 1411-1423. DOI:10.1007/s00134-015-3934-7 |
| [3] | Soliman IW, Frencken JF, Peelen LM, et al. The predictive value of early acute kidney injury for long-term survival and quality of life of critically ill patients[J]. Crit Care, 2016, 20(1): 242. DOI:10.1186/s13054-016-1416-0 |
| [4] | Kellum JA, Romagnani P, Ashuntantang G, et al. Acute kidney injury[J]. Nat Rev Dis Primers, 2021, 7: 52. DOI:10.1038/s41572-021-00284-z |
| [5] | Hsu CY, Ordoñez JD, Chertow GM, et al. The risk of acute renal failure in patients with chronic kidney disease[J]. Kidney Int, 2008, 74(1): 101-107. DOI:10.1038/ki.2008.107 |
| [6] | Ishani A, Xue JL, Himmelfarb J, et al. Acute kidney injury increases risk of ESRD among elderly[J]. J Am Soc Nephrol, 2009, 20(1): 223-228. DOI:10.1681/ASN.2007080837 |
| [7] | Wu VC, Huang TM, Lai CF, et al. Acute-on-chronic kidney injury at hospital discharge is associated with long-term dialysis and mortality[J]. Kidney Int, 2011, 80(11): 1222-1230. DOI:10.1038/ki.2011.259 |
| [8] | Barrantes F, Tian JM, Vazquez R, et al. Acute kidney injury criteria predict outcomes of critically ill patients[J]. Crit Care Med, 2008, 36(5): 1397-1403. DOI:10.1097/CCM.0b013e318168fbe0 |
| [9] | Lassnigg A, Schmidlin D, Mouhieddine M, et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study[J]. J Am Soc Nephrol, 2004, 15(6): 1597-1605. DOI:10.1097/01.asn.0000130340.93930.dd |
| [10] | Xu X, Wang L, Xiong MQ, et al. New criterion to evaluate acute-on-chronic kidney injury based on the creatinine reference change[J]. Am J Nephrol, 2020, 51(6): 453-462. DOI:10.1159/000506664 |
| [11] | Hong DJ, Ren QH, Zhang J, et al. A new criteria for acute on preexisting kidney dysfunction in critically ill patients[J]. Ren Fail, 2023, 45(1): 2173498. DOI:10.1080/0886022X.2023.2173498 |
| [12] | Warnock DG, Neyra JA, Macedo E, et al. Comparison of static and dynamic baseline creatinine surrogates for defining acute kidney injury[J]. Nephron, 2021, 145(6): 664-674. DOI:10.1159/000516953 |
| [13] | Disease KJKI. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group[EB]. 2012, 2: 1-138. |
| [14] | GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI:10.1016/S0140-6736(20)30045-3 |
| [15] | Sarnak MJ, Levey AS, Schoolwerth AC, et al. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention[J]. Circulation, 2003, 108(17): 2154-2169. DOI:10.1161/01.CIR.0000095676.90936.80 |
| [16] | Drawz P, Rahman M. Chronic kidney disease[J]. Ann Intern Med, 2015, 162(11): ITC1-ITC16. DOI:10.7326/aitc201506020 |
| [17] | Foundation NK. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification[J]. Am J Kidney Dis, 2002, 39(2 Suppl 1): S1-266. |
| [18] | Eckardt KU, Kasiske BL. Kidney disease: improving global outcomes[J]. Nat Rev Nephrol, 2009, 5(11): 650-657. DOI:10.1038/nrneph.2009.153 |
| [19] | Thomas ME, Blaine C, Dawnay A, et al. The definition of acute kidney injury and its use in practice[J]. Kidney Int, 2015, 87(1): 62-73. DOI:10.1038/ki.2014.328 |
| [20] | Siew ED, Alp Ikizler T, Matheny ME, et al. Estimating baseline kidney function in hospitalized patients with impaired kidney function[J]. Clin J Am Soc Nephrol, 2012, 7(5): 712-719. DOI:10.2215/CJN.10821011 |
| [21] | Hsu CY, Ordoñez JD, Chertow GM, et al. The risk of acute renal failure in patients with chronic kidney disease[J]. Kidney Int, 2008, 74(1): 101-107. DOI:10.1038/ki.2008.107 |
| [22] | Lo LJ, Go AS, Chertow GM, et al. Dialysis-requiring acute renal failure increases the risk of progressive chronic kidney disease[J]. Kidney Int, 2009, 76(8): 893-899. DOI:10.1038/ki.2009.289 |
| [23] | Buckenmayer A, Siebler N, Haas CS. Pre-existing chronic kidney disease, aetiology of acute kidney injury and infection do not affect renal outcome and mortality[J]. J Nephrol, 2024, 37(2): 391-400. DOI:10.1007/s40620-023-01774-x |
| [24] | Zeng XX, McMahon GM, Brunelli SM, et al. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals[J]. Clin J Am Soc Nephrol, 2014, 9(1): 12-20. DOI:10.2215/CJN.02730313 |
| [25] | Kellum JA, Sileanu FE, Murugan R, et al. Classifying AKI by urine output versus serum creatinine level[J]. J Am Soc Nephrol, 2015, 26(9): 2231-2238. DOI:10.1681/ASN.2014070724 |
| [26] | Sun L, Hua RX, Wu Y, et al. Acute kidney injury in hospitalized adults with chronic kidney disease: comparing cROCK, KDIGO, and combined criteria[J]. Kidney Res Clin Pract, 2023, 42(5): 639-548. DOI:10.23876/j.krcp.22.161 |
| [27] | 高益锐, 李强, 曾瑞峰, 等. 脓毒症相关性急性肾损伤的临床特点分析: 197例回顾性分析[J]. 中华急诊医学杂志, 2022, 31(10): 1368-1372. DOI:10.3760/cma.j.issn.1671-0282.2022.10.012 |
| [28] | 李雪芳, 金魁, 田丽源, 等. 急诊危重患者急性肾损伤发生的危险因素分析[J]. 中华急诊医学杂志, 2021, 30(6): 749-753. DOI:10.3760/cma.j.issn.1671-0282.2021.06.019 |
 2025, Vol. 34
2025, Vol. 34