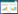心脏骤停(cardiac arrest, CA)及自主循环恢复(return of spontaneous circulation, ROSC)后脑缺血及缺血-再灌注损伤双重打击所造成的缺氧-缺血性脑损伤(hypoxic-ischemic brain injury, HIBI)是导致幸存者死亡和长期神经功能障碍的主要原因。脑肠轴(brain-gut axis, GBA)的双向调节作用在HIBI过程中扮演重要角色,但目前其具体功能和相关机制尚未阐明,本综述对GBA在CA/ROSC后HIBI中的涉及的多种机制的双向调节研究进展进行总结分析。
1 CA/ROSC后HIBI中神经-血管单元(neurovascular unit, NVU)的“双重打击”病理变化最近研究显示伴随脑血流及脑代谢在时间-空间的动态演进,CA/ROSC后HIBI包括缺血性去极化、再灌注再极化、脑结构-功能失调、以及神经修复四个序贯发生、部分重叠病理阶段。缺血性去极化损伤发生于CA期间几分钟内的血液循环完全停止后,脑氧及葡萄糖储备的快速消耗导致ATP消耗以及线粒体内膜电位丧失。对CA患者的抢救后随着ROSC的恢复,心肺复苏产生大约正常脑血流量的1/5,远低于维持细胞完整性和正常代谢所需,进入低灌注阶段,HIBI仍然随时间持续进展(5~30 min),形成再灌注复极化期[1]。在ROSC后几分钟到几小时开始持续数小时到几天,NVU中发生了炎症反应、脑水肿、兴奋性氨基酸毒性、细胞内钙超载、能量代谢障碍、线粒体死亡途径、蛋白质错误折叠、氧化应激、自由基损伤、凝血异常和细胞凋亡/死亡等紊乱,除了这些发生在细胞水平的机制外,还发生了血管失调,共同造成脑部结构-功能失调[1-2]。ROSC期间的再灌注触发了一系列导致继发性脑损伤的机制。即CA后脑神经的结构及功能收受了缺血及缺血-再灌注损伤所造成的双重[3]脑损伤后数天数后是周至更长时间认知功能的觉醒和恢复,大脑恢复和修复期[1]。见图 1。
|
| 图 1 CA/ROSC后HIBI序贯发生、部分重叠四个病理阶段 |
|
|
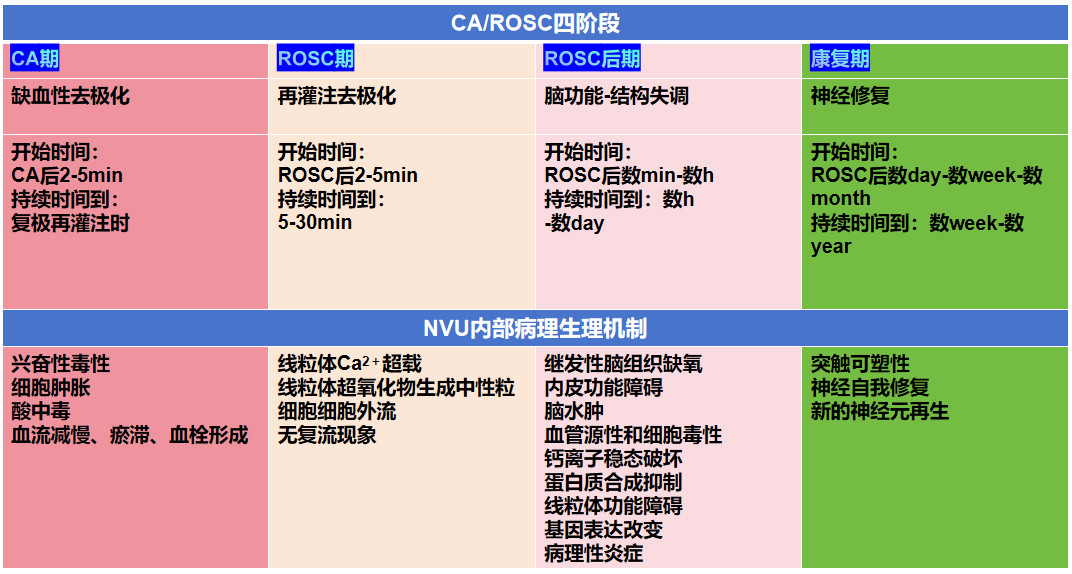
相对于分离性的观察脑血管以及脑神经的损伤,近年来逐渐把NVU作为脑损伤综合性治疗的靶点,其中NVU主要由脑血管内皮细胞、神经元以及神经胶质细胞三者紧密交织而成的功能复合体[4]。其中:(1)脑血管内皮细胞包括如毛细血管和小静脉上的周细胞、小动脉上的基底膜和平滑肌细胞,是NVU中的主要血管舒缩效应器,调节血液运输[5],相邻细胞不连续的空间主要有细胞旁组织基底膜填充,维护神经系统完整性[6]。(2)神经元通过树突和轴突建立信号传输,神经元被神经胶质细胞包裹防止与血管细胞直接接触,并缓冲血液传播物质的影响[7]。(3)神经胶质细胞主要包括星形胶质细胞,其主要包裹毛细血管和小动脉构成NVU中最远腔的层。小胶质细胞是另一种类型的胶质细胞,在NVU中通过消除垂死的神经元和修剪无功能的突触来调节大脑功能,是中枢神经系统血管周围的免疫细胞[8]。NVU的原型功能中的一个重要作用是神经血管耦连,神经活动和血流之间的联系是响应于神经元代谢需求,具有高度的空间和时间对应性,如星形胶质细胞接受来自神经元释放的Ca2+、神经递质及自身产生释放分子介质从而激活平滑肌细胞改变血流灌注[9];周细胞可通过释放各种分子物质舒缩血管直径、改变血管通透性调整血管循环[10]。其中由内皮细胞、胶质细胞、周细胞、神经元突起和基底膜组成的血脑屏障(blood-brain barrier, BBB)是血液和中枢神经系统之间复杂而动态的界面,主要负责运输脑细胞正常代谢所必需的营养物质,并阻碍许多有毒化合物进入中枢神经系统,从而维持NVU微环境的稳态,为中枢神经系统的正常运作提供了重要支撑[11]。见图 2。
|
| 图 2 NVU功能复合体构成 |
|
|
上文中笔者提到CA/ROSC后HIBI时的病理生理过程涉及等多个方面,已知NVU是一个高度协调的系统,在HIBI时各个组成部分均受到不同程度的损坏(图 2)。
脑缺血时神经元释放大量的谷氨酸这种兴奋性神经递质刺激突触后神经元上的递质受体引起神经细胞兴奋性毒性。刺激突触后神经元上的递质受体可引发神经细胞兴奋性毒性。此过程主要涵盖两个方面:其一,谷氨酸与突触后受体相结合,此时钠离子通道开启,大量的钠离子内流,进而导致神经元出现急性细胞水肿并死亡。此外,钙泵受损、Ca2+通道开放致胞内Ca2+超载及NO生成增加[12]。此外脑缺血时无氧呼吸增加,细胞内pH值降低,再灌注时,Na+/H+交换器被激活,引起大量Na+内流,维持酸碱平衡,同时脑缺血引起的低ATP水平也减弱了Na+泵的活性致细胞内Na+水平升高[7]。
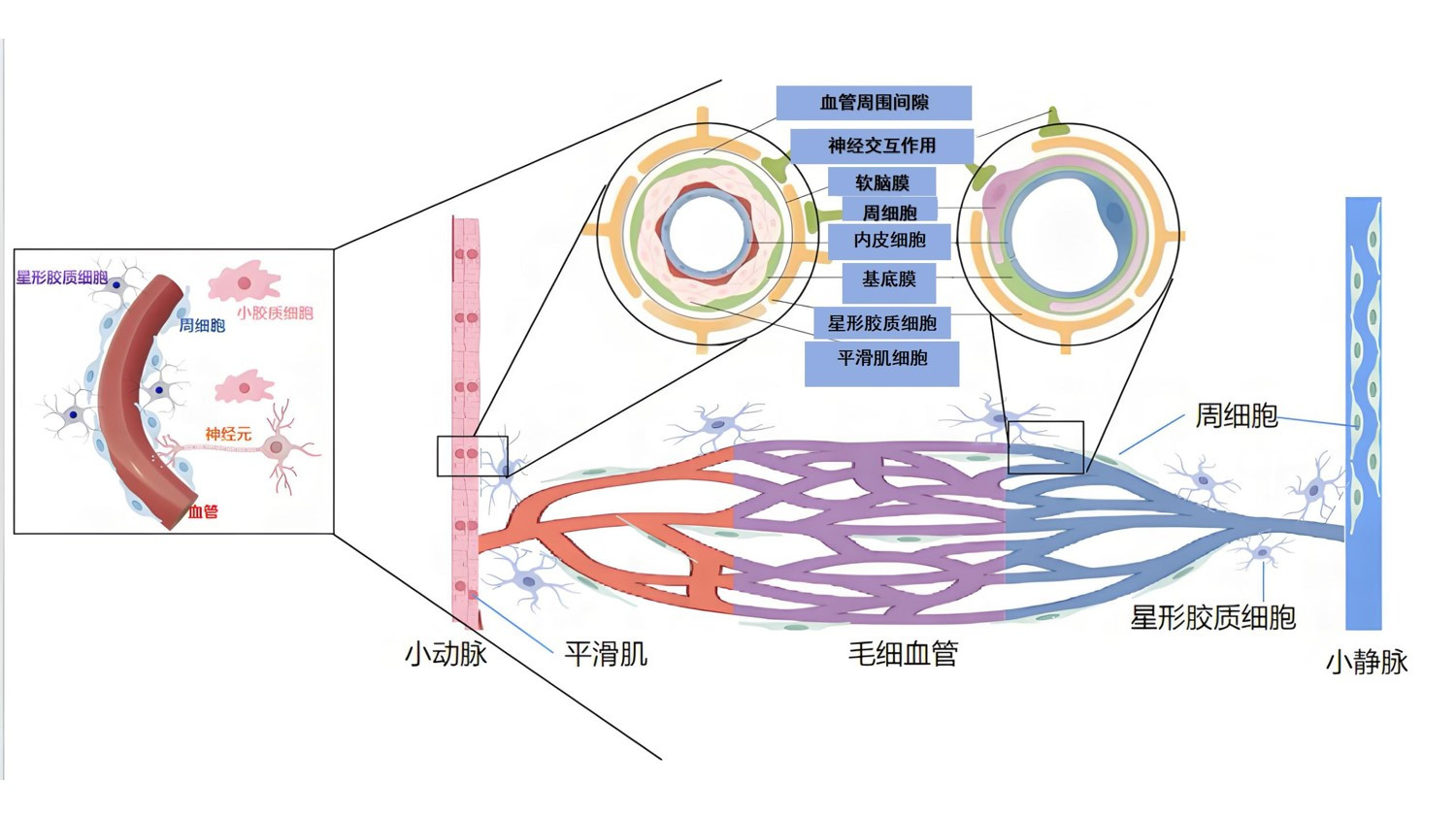
在ROSC脑缺血-再灌注时随着氧供恢复,细胞内Na+/Ca2+交换器失衡,Ca2+超载进一步破坏线粒体功能,促进活性氧(ROS)的过度产生[13]。包括过氧化氢(H2O2)在内的大量ROS可诱导氧化应激。这通过多种机制发生,如烟酰胺腺嘌呤二核苷酸磷酸氧化酶系统和NO合酶系统,最终通过引发DNA损伤、脂质过氧化、细胞骨架结构损伤和趋化性导致细胞凋亡和坏死、自噬等一系连锁反应[14]再灌注时生成大量的超氧化物O2-,NO与O2-同反应产生亚硝酸阴离子OONO-,进一步加重神经细胞氧化损伤。内皮细胞受损后会引起BBB通透性增加;与此同时自由基通过刺激炎症附分子的表达、多糖降解、谷氨酸递质释放增加等机制从而加重脑组织再灌注损伤[7]。炎症免疫反应在HIBI中起着关键性的作用。脑缺血损伤后,周细胞[15]、星形胶质细胞[16]、小胶质细胞[17]、血管内皮细胞[18]等首先促进白细胞的迁移、释放炎症因子促进脑炎症,其次通过释放血管内皮生长因子和基质金属蛋白酶降解BBB中的连接蛋白导致其破坏[7]。周细胞还可通过释放炎症因子收缩血管直径、降低脑血流量并恶化脑缺血,同时通过释放缺氧诱导因子而增强血管通透性[10]。随着缺血再灌注进行,小胶质细胞激活的Toll样受体进一步加重神经炎症[19],同时ROSC后炎症进一步加重,会激活特异性凝血通路、内源性纤维蛋白原溶解不足以及血流淤滞等为后续脑内微血管形成创造条件。在Yepes等[20]的研究发现,ROSC后患者体内D-二聚体含量明显升高,同时凝血酶原时间、活化部分凝血活酶时间、INR以及纤维蛋白原含量均明显增高[21]。研究表明,这些细胞在HIBI中发挥双重调节机制。星形胶质在脑缺血初期的适当增值会在损伤部位与健康组织之间形成隔离起到保护作用,随着缺血缺氧再灌注时过度增殖导致胶质瘢痕的形成也会加重脑损伤[22],星形胶质细胞还通过释放抗炎因子如IL-10、细胞外基质增强BBB完整性;通过释放抗氧化剂如谷胱甘肽、抗坏血酸和增加转录因子如NF-E2相关因子2(Nrf 2)的表达发挥抗氧化应激[16];释放细胞细胞色素P450 4A/20-羟基二十碳四烯酸参与HIBI的血管生成及释放多种神经营养因子保护神经元[23],这些共同减轻脑损伤,促进神经再生。小胶质细胞在HIBI间的双重作用表现基于M1、M2两种细胞形式,其中M1变现促炎,而M2型可能通过抗炎因子使得连接蛋白的表达增强从而保持BBB的完整性[17]。此外,小胶质细胞还参与突触重塑,在促进神经回路精细化方面具有重要意义[7]。血管内皮细胞通过与支持细胞相互作用可调节紧密连接蛋白和咬合蛋白以及通过自噬作用进而保持BBB完整性,此外还可表达胰岛素样生长因子-1可减少神经元丢失促进神经修复[24],作为血浆与内皮细胞之间的屏障-脑微血管内皮糖萼具有抗凝血作用和发挥保护BBB作用[7]。综上所述,NVU在HIBI中的病理生理过程中发挥着举足轻重的作用,其中Ca2+超载和氧化应激被广泛认为是关键因素。见图 3。
|
| 注:脑氧气输送减少致神经元代谢降低,ATP量降低,Ca2+超载致线粒体毒性,进一步减少ATP,无法维持细胞代谢,细胞水肿、凋亡、死亡。此外,在微血管中,炎症因子释放、内皮细胞受损、氧化应激、血流淤滞等导致血脑屏障受损加重脑水肿、微血栓形成限制血流量 图 3 HIBI时原发性、继发性损伤时微血管及细胞的病理生理示意图 |
|
|
CA/ROSC后不仅由于心脏骤停时最初的全身缺血和无血流局部循环障碍直接导致胃肠道的缺血灌注不足及随着循环的恢复缺血-再灌注所造成的双重打击的损伤[3],更是由于脑神经损伤后引发肠道一系列的反应,后造成的应激性溃疡的发生造成的三重打击最终触发肠道炎症反应、神经-内分泌反应、微生物移位,肠道屏障破坏、肠道出血的病理反应破坏肠道的生理构造和功能,导致肠道微生物环境的紊乱[25]早期在疾病发生的几小时内就会迅速发生,后期持续数天以上,具体机制如下:(1)在CA后心输出量显著降低时,机体为守护重要的脑组织血供,致使胃肠血流处于低灌注状态,此外,缺血性脑损伤时机体产生应激后反应致使全身交感神经兴奋性提升,血液中儿茶酚胺水平增高引发内脏血管痉挛,使得胃肠道的血流灌注减少,肠粘膜因缺血缺氧而遭受损伤,肠道黏膜屏障因此而受到破坏导致应激性溃疡和胃肠道出血[26]。(2)脑损伤时交感神经兴奋性增高,刺激迷走神经,导致胃蛋白酶和胃酸的高分泌进一步加重胃肠道出血风险,此外胃黏膜屏障受到破坏、管通透性增大,定植在胃肠道的正常菌群及大量炎症因子及有害菌群渗透到血液,造成全身炎症反应,进一步加重了胃肠道损伤程度[27]。(3)ROSC再灌注后可导致大量自由基释放、前列腺素(尤其是前列腺素E2)与碳酸氢盐水平的下降、黏膜内炎症细胞大量聚集等,共同作用导致肠道紧密连接受损、肠道通透性增加,肠道细菌及其产物可穿过肠道屏障并参与全身血液循环,激活机体免疫炎症反应进一步引起脑神经功能损伤[28]。(4)CA/ROSC及HIBI均会使得血小板计数下降、凝血酶原时间及活化部分凝血活酶时间延长导致凝血功能障碍[21],从而加重胃肠道出血。(5)肠道运动功能受损由于CA后缺血后低灌注及HIBI时儿茶酚胺大量释放使血管收缩痉挛导致胃肠运动功能障碍,具体表现为腹胀、腹泻、胃潴留等症状,严重时甚至会出现中毒性肠麻痹[29]。(6)肠黏膜营养吸收的改变表现为脑损伤后由于其高消耗状态,负氮平衡,蛋白分解加速而合成不足,从而使得胃黏膜的修复能力下降导致胃肠道出血;另一方面,脑缺血-再灌注后肠道微生物群多样性遭到破坏, 肠道菌群失调进一步导致营养物质吸收障碍[30]。这一现象不仅直接破坏肠道的结构和功能,导致肠道微生物环境的紊乱,更通过引发一系列的炎症反应进一步加剧脑损伤的程度。见图 4。
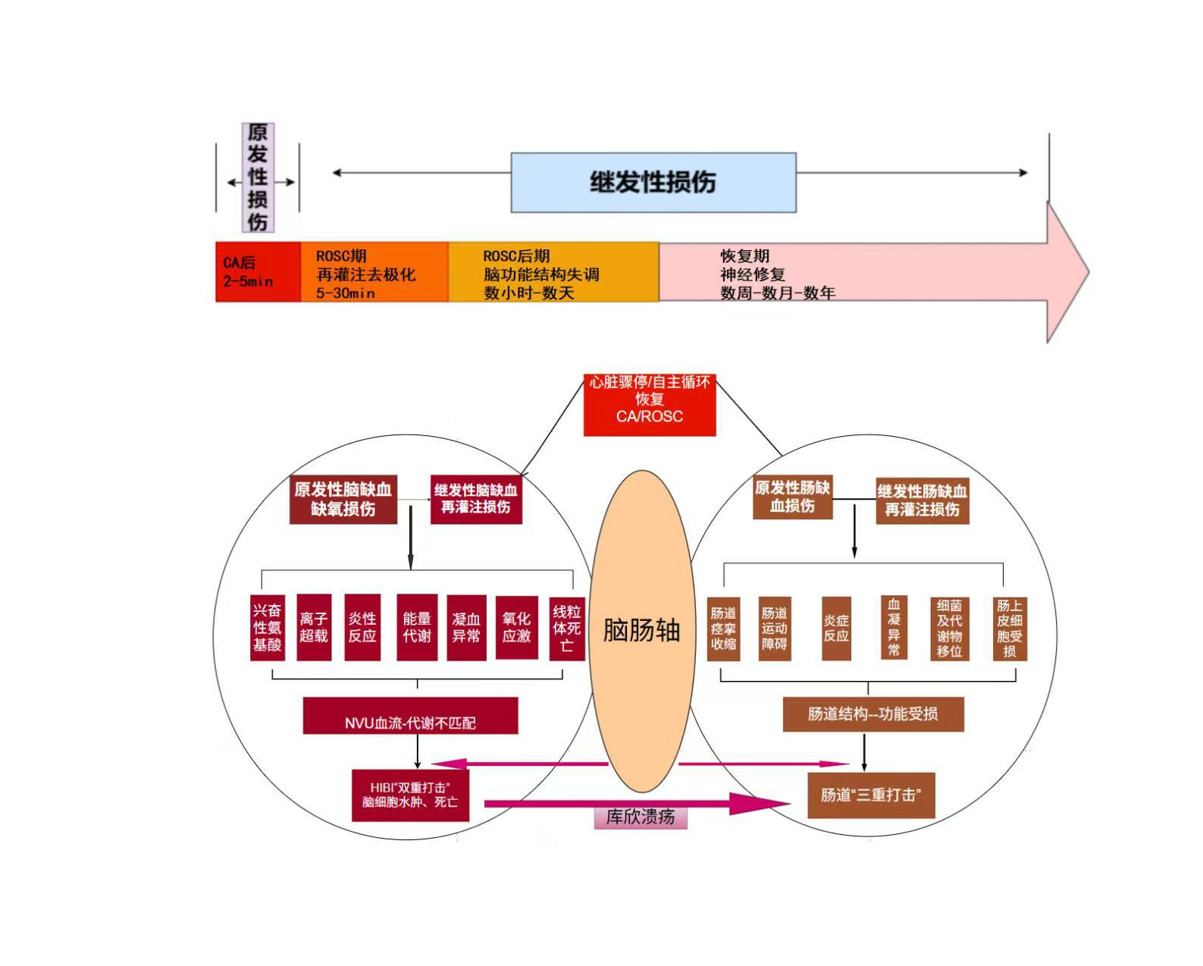
|
| 图 4 CA/ROSC后肠道“三重打击”的病理机制图 |
|
|
颅脑与肠皆起源于早期胚胎的神经嵴。在发育过程中,一部分神经嵴细胞进入中枢神经系统,而另一部分则演变成了肠神经系统。脑与肠之间的紧密结构联系、功能交互及其相互作用被称为脑-肠轴[31]。其中肠道微生态系统的动态平衡在脑肠轴的调节过程中扮演着至关重要的角色[32],中枢系统和肠道之间的信号通路是双向的,上下通路的双向调节存在着神经元和非神经元途径,这其中主要通过自主神经系统通路、神经内分泌通路-下丘脑-垂体-肾上腺轴(HPA轴)、免疫通路和肠道微生物代谢通路等复杂机制[33]。在这个庞大的系统中,任何微小的失衡都可能触发过度反应导致脑肠轴系统紊乱,造成中枢神经系统炎症进一步加重,这也是HIBI患者预后不良的重要原因之一。
肠道和大脑之间的双向神经解剖学通路是通过传入或传出神经沿两个方向传递发生的[31],脑肠轴的神经解剖学主要包括迷走神经(vagus nerve, VN)和肠神经系统,许媛[34]研究表明VN直接连接肠腔和脑干,在脑肠轴神经系统的信息传递中起关键作用,VN在自上而下的调节作用中通过神经末梢释放神经递质激活肠神经肌丛肠内分泌细胞突触来调节的肠道微生物群,肠神经系统中的感觉神经元与肠运动神经元和迷走神经纤维形成突触,肠道微生物及其代谢物包括短链脂肪酸、吲哚、胆汁和脂多糖通过自下而上的调节作用刺激传入纤维传递到下丘脑神经元,影响神经元递质的释放,调节脑功能[35]。此外,有动物实验表明[36]脑损伤后刺激胰高血糖素样肽-1受体激动剂分泌增多,其可通过刺激神经细胞分化、加强突触可塑性以及促进神经递质的分泌,从而改善神经系统的状态,并减轻全身的炎症反应。
在HIBI神经内分泌途径中下丘脑-垂体-肾上腺轴被激活,使得神经内分泌调节紊乱[37],进而会引起胃肠激素、去甲肾上腺素、皮质醇等激素的高表达,这些激素会破坏肠道紧密连接,增加胃肠道血管的通透性,破坏肠道黏膜及正常的胃肠道功能,使胃肠道内的细菌有机会进入血液,进一步加剧了全身的炎症反应,同时脑细胞会进一步水肿、炎细胞会浸润,这些刺激会传递到大脑皮质的内脏中枢,然后信号会进一步传递到下丘脑、垂体以及胃肠道等靶器官释放大量胃酸,破坏粘膜上皮细胞,发生细胞氧化反应从而进一步加重缺血缺氧后的脑组织损伤,甚至影响了患者的整体预后[38]。
在身体健康状态时由于肠屏障和血脑屏障两个生理结构的存在,肠道微生物组与大脑之间的免疫信号传递受到严格的控制。胃肠道是全身免疫细胞最大的聚集地,其功能稳态直接影响着免疫系统的稳定性[33]。研究表明[39]CA诱导的HIBI会致使小鼠肠道上皮细胞间紧密连接降低、肠屏障受损,肠道细菌及其产物可穿过受损的肠上皮细胞,同时会刺激免疫T淋巴细胞,这些受刺激的T细胞会产生大量的炎症因子,其中最具代表性的是IL-17,IL-17分泌入血后诱发全身炎症反应,其中另有研究发现IL-17经过受损的血脑屏障BBB进入脑组织后继续引发IL-6和TNF-α等炎症因子分泌,这些炎症因子它们可以进一步加重脑细胞水肿、加重脑组织的损伤[26]。
研究发现某些肠道菌群及其代谢物在胃肠道与大脑之间的联系中充当着至关重要的信号分子,可以通过刺激迷走神经直接调节大脑功能[40]。Checa-Ros等[41]文章中指出肠道微生物组产生短链脂肪酸,可能通过上调抗氧化酶(如谷胱甘肽过氧化物酶和过氧化氢酶)的活性来对抗氧化应激,并通过多种转录因子影响线粒体能量代谢,其机制尚不清楚。此外,Welathanthree等[42]大鼠的实验中进一步发现SCFA代谢产物丁酸具有抗炎特性,通过诱导抗炎IL-10的释放并抑制炎性前细胞因子(IL-6, IL-12)。SCFA通过肠内分泌细胞释放钙依赖性5HT,并将其传递到表达5HT3R(3型血清素受体)的邻近迷走神经末梢,信号在几毫秒内上升到脑干的迷走神经核,再经中枢神经系统对肠神经调节相关影响,除此5HT通过激活B、T淋巴细胞驱动抗炎巨噬细胞极化对脑损伤后的免疫反应有直接和间接的影响[42-43]。近几年许多研究者[44]提出内毒素-脂多糖途径以及色氨酸途径,认为当胃肠道的有害菌群进入血液时,会分泌出如内毒素-脂多糖、色氨酸代谢产物等物质,这些物质会进一步诱发免疫炎症反应。但是,具体机制仍然不明确。见图 5。
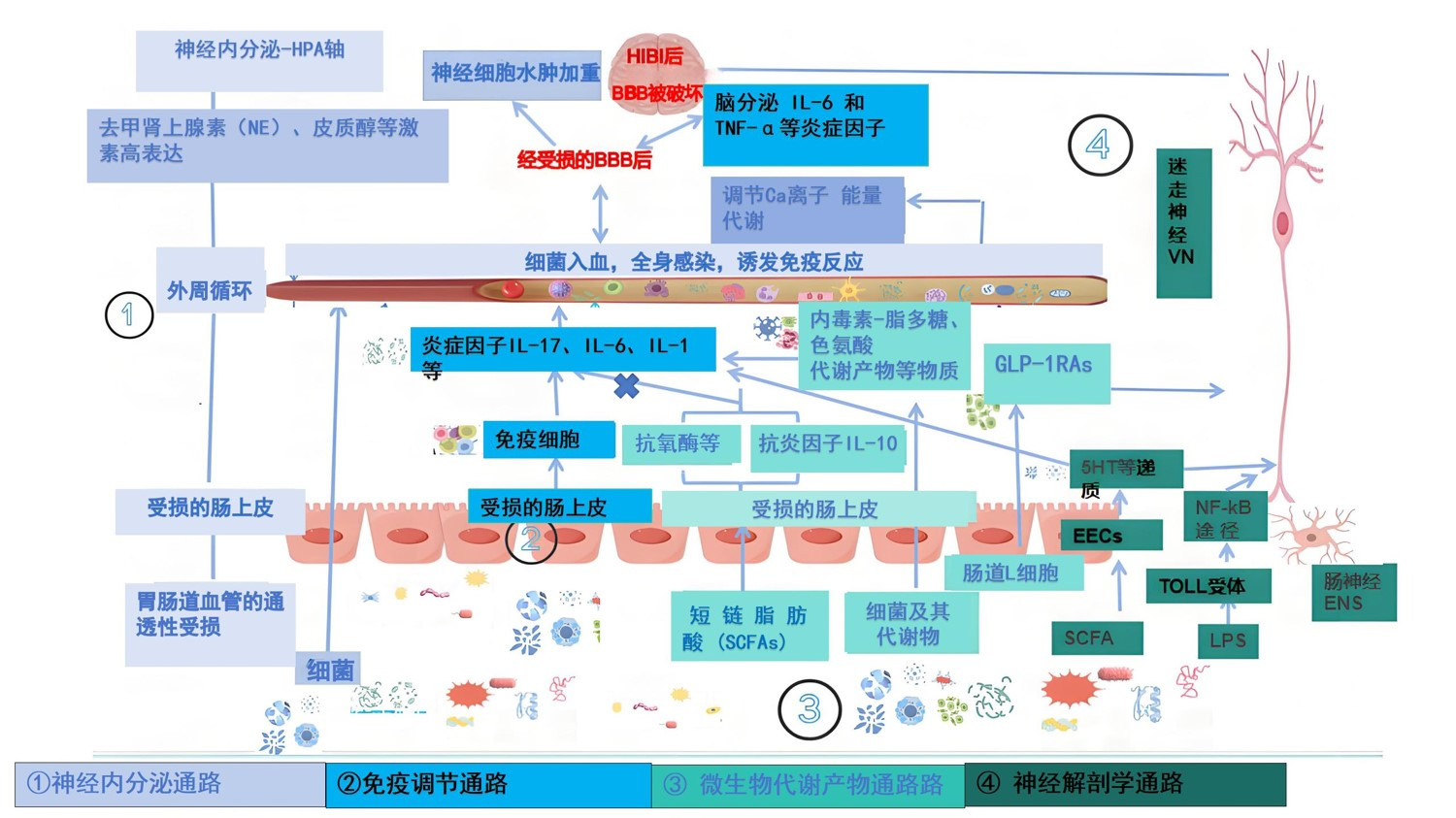
|
| 图 5 脑肠轴的四种主要机制的双向作用示意图 |
|
|
综上,中枢神经系统与肠道之间存在千丝万缕的关系,但尚未完全明确,但可以明确的是肠道微生物在神经系统预后中起到至关重要的作用,是今后“微生物-肠-脑轴”领域中的重要研究焦点。需要指出的是,上面所提及的脑肠轴在HIBI中涉及的多种机制的双向调节并非独立进行的,通常是各种机制之间相互促进、同时进行的,造成最终的神经系统的损伤。因此,深入研究脑肠轴的免疫和炎症反应的调节的工作原理和调控机制,对于理解和治疗缺血性缺氧性脑损伤疾病具有重要的临床意义。
4 应用脑肠轴在HIBI中的干预策略目前,研究较多的干预措施是针对神经功能障碍、微生物菌群失调和或全身炎症的治疗。Guo等[45]研究显示抗生素干预后会对T细胞增殖及IL-17的分泌产生抑制进而对失衡的肠道微生态进行调节,起到对脑部炎症损伤的保护作用。已有研究证明低发酵的糖类以及多元醇饮食或许会致使微生物发酵程度降低,使气体以及渗透活性代谢产物的生成减少,进而改善腹胀、肠胃胀气和疼痛等症状[46]。5-HT4激动剂(如普鲁卡必利)已在以便秘症状为主的肠易激综合征的治疗中取得成功,然而目前尚无关于使用5-HT药物治疗脑损伤后肠内菌群失调的报道。研究表明[47]多种益生菌、益生元可以改善大鼠的肠道完整性、调节紧密连接蛋白对上皮屏障具有保护作用、抑制小胶质细胞过度激活的[39]、影响色氨酸相关通路[44]、提高脑缺血缺氧后肠胰高血糖素样肽1的分泌减轻炎症性肠道损伤,改善神经功能缺损从而改善预后。早期肠内营养干预后可能通过改善胃肠道微环境,降低HIBI后大鼠胃肠黏膜组织氧化应激反应,进一步改善全身免疫炎症反应[48];但临床中要根据患者具体情况选择适合的营养液、评估肠内营养的时机、营养液剂量及营养方式如肠外营养。另有研究发现便粪菌群移植可以影响肠道微生物群组的结构和肠屏障功能来通过调控肠-脑轴抑制小胶质细胞和星形胶质细胞的活化,平衡受损部位神经血管单元NVU的内环境稳态、促进神经功能恢复[49]。见图 6。
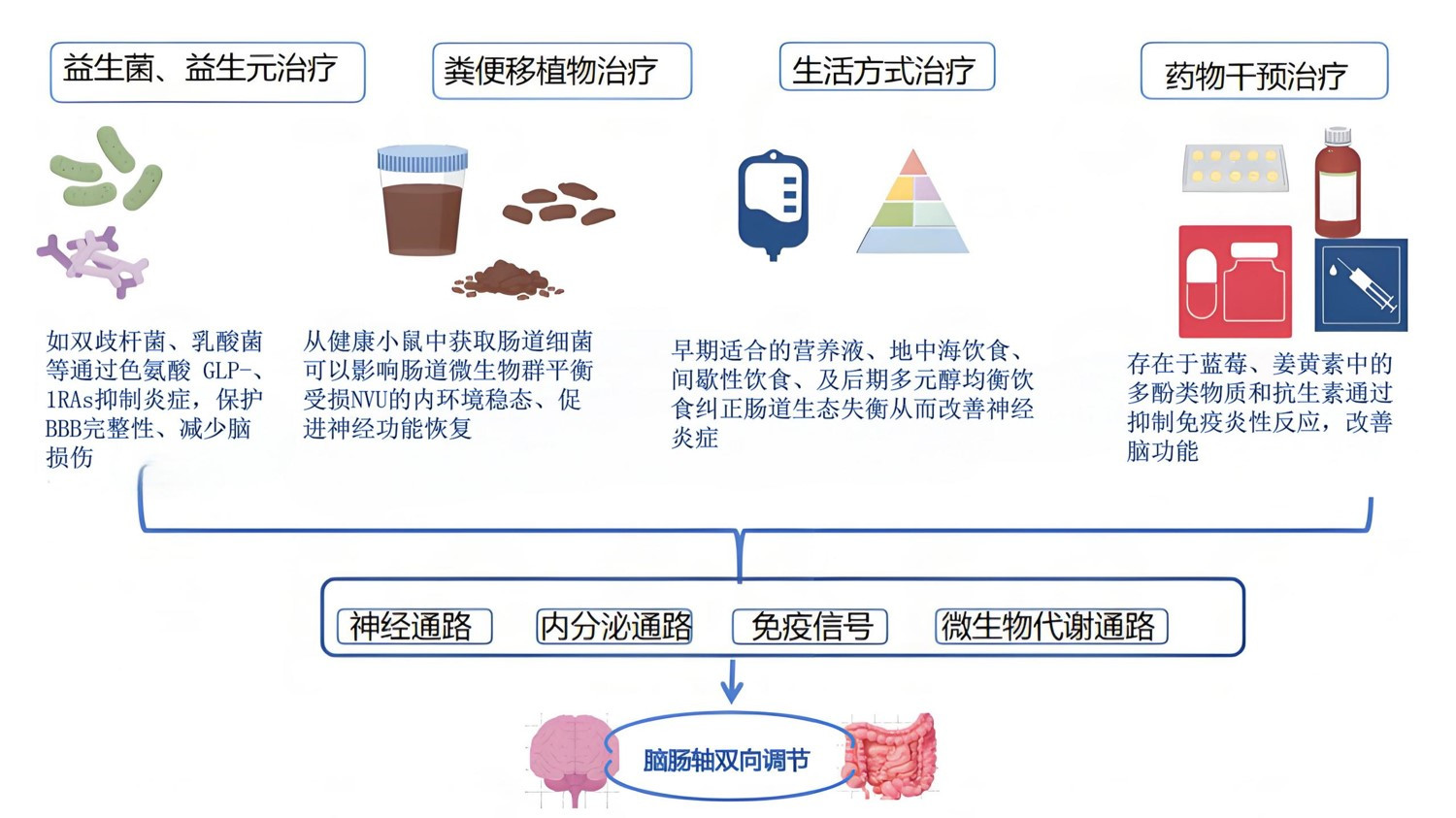
|
| 图 6 目前基于脑肠轴在HIBI中的主要干预策略 |
|
|
综上所述,肠道通过免疫反应、神经通路、神经-内分泌调节、肠道微生物及代谢产物调节等途径参与了HIBI后神经血管单元NVU的病理生理机制。从肠脑轴角度深入探讨HIBI发病机制和探寻其的治疗方法可能是CA/ROCS后HIBI的研究方向,目前涉及应用脑肠轴在在HIBI中的干预策略的研究许多是涉及动物模型或细胞培养,能有效地转化为临床治疗还有待观察。本课题组后期将基于脑肠轴理论给予CA/ROSC的早期大鼠冰盐水联合去甲肾上腺素胃内灌注研究对HIBI的调节作用机制。
利益冲突 所有作者声明无利益冲突
| [1] | Perkins GD, Neumar R, Hsu CH, et al. Improving outcomes after post-cardiac arrest brain injury: a scientific statement from the international liaison committee on resuscitation[J]. Circulation, 2024. DOI:10.1161/CIR.0000000000001219 |
| [2] | Katz A, Brosnahan SB, Papadopoulos J, et al. Pharmacologic neuroprotection in ischemic brain injury after cardiac arrest[J]. Ann N Y Acad Sci, 2022, 1507(1): 49-59. DOI:10.1111/nyas.14613 |
| [3] | Sekhon MS, Ainslie PN, Griesdale DE. Clinical pathophysiology of hypoxic ischemic brain injury after cardiac arrest: a "two-hit" model[J]. Crit Care, 2017, 21(1): 90. DOI:10.1186/s13054-017-1670-9 |
| [4] | Zhou RB, Li JZ, Wang RD, et al. The neurovascular unit in healthy and injured spinal cord[J]. J Cereb Blood Flow Metab, 2023, 43(9): 1437-1455. DOI:10.1177/0271678X231172008 |
| [5] | Zhao YB, Gan L, Ren L, et al. Factors influencing the blood-brain barrier permeability[J]. Brain Res, 2022, 1788: 147937. DOI:10.1016/j.brainres.2022.147937 |
| [6] | Wu BX, Zhou DB, Mei ZG. Targeting the neurovascular unit: Therapeutic potential of traditional Chinese medicine for the treatment of stroke[J]. Heliyon, 2024, 10(19): e38200. DOI:10.1016/j.heliyon.2024.e38200 |
| [7] | Haruwaka K, Ikegami A, Tachibana Y, et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation[J]. Nat Commun, 2019, 10(1): 5816. DOI:10.1038/s41467-019-13812-z |
| [8] | van den Bosch AMR, Hamann J. Gi signaling controls microglial surveillance and neuronal synchronization[J]. Trends Neurosci, 2025, 48(6): 393-394. DOI:10.1016/j.tins.2025.04.006 |
| [9] | Lu WZ, Wen JY. Crosstalk among glial cells in the blood-brain barrier injury after ischemic stroke[J]. Mol Neurobiol, 2024, 61(9): 6161-6174. DOI:10.1007/s12035-024-03939-6 |
| [10] | 李兆珍, 张丹参. 脑缺血再灌注损伤相关机制的研究进展[J]. 神经药理学报, 2020, 10(6): 60-63. DOI:10.3969/j.issn.2095-1396.2020.06.011 |
| [11] | Ajoolabady A, Wang SY, Kroemer G, et al. Targeting autophagy in ischemic stroke: from molecular mechanisms to clinical therapeutics[J]. Pharmacol Ther, 2021, 225: 107848. DOI:10.1016/j.pharmthera.2021.107848 |
| [12] | Huang ML, Zhang LH, Gu CY, et al. Research progress on the effects of mitochondrial-associated endoplasmic reticulum membranes tethering proteins interaction on cerebral ischemia/reperfusion[J]. Sheng Li Xue Bao Acta Physiol Sin, 2024, 76(5): 801-808. |
| [13] | Sezer G, Sahin F, Celik N, et al. Protective effects of minocycline on dermal fibroblast cells from oxidant and apoptotic effects of H2O2: a comprehensive analysis with Raman spectroscopy and data-driven approach[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2025, 343: 126609. DOI:10.1016/j.saa.2025.126609 |
| [14] | Gao P, Yi J, Chen WJ, et al. Pericyte-derived exosomal miR-210 improves mitochondrial function and inhibits lipid peroxidation in vascular endothelial cells after traumatic spinal cord injury by activating JAK1/STAT3 signaling pathway[J]. J Nanobiotechnology, 2023, 21(1): 452. DOI:10.1186/s12951-023-02110-y |
| [15] | Choi HJ, Kim NE, Kwon I, et al. Fc-saxatilin inhibits VEGF-induced permeability by regulating claudin-5 expression in human brain microvascular endothelial cells[J]. Microvasc Res, 2020, 128: 103953. DOI:10.1016/j.mvr.2019.103953 |
| [16] | Sobral AF, Costa I, Teixeira V, et al. Molecular motors in blood-brain barrier maintenance by astrocytes[J]. Brain Sci, 2025, 15(3): 279. DOI:10.3390/brainsci15030279 |
| [17] | Yu YL, Liao XL, Xie XY, et al. The role of neuroglial cells communication in ischemic stroke[J]. Brain Res Bull, 2024, 209: 110910. DOI:10.1016/j.brainresbull.2024.110910 |
| [18] | Lu HD, Li SN, Dai DW, et al. Enhanced treatment of cerebral ischemia-Reperfusion injury by intelligent nanocarriers through the regulation of neurovascular units[J]. Acta Biomater, 2022, 147: 314-326. DOI:10.1016/j.actbio.2022.05.021 |
| [19] | Ji CL, Sheng L, Han KJ, et al. Microglial intervention in ischemic stroke: roles and intervention strategies[J]. Neural Regen Res, 2026, 21(2): 443-454. DOI:10.4103/NRR.NRR-D-24-01166 |
| [20] | Yepes M, Woo Y, Martin-Jimenez C. Plasminogen activators in neurovascular and neurodegenerative disorders[J]. Int J Mol Sci, 2021, 22(9): 4380. DOI:10.3390/ijms22094380 |
| [21] | Yepes M. Fibrinolytic and non-fibrinolytic roles of tissue-type plasminogen activator in the ischemic brain[J]. Neuroscience, 2024, 542: 69-80. DOI:10.1016/j.neuroscience.2023.08.011 |
| [22] | Patel JC, Shukla M, Shukla M. Cellular and molecular interactions in CNS injury: the role of immune cells and inflammatory responses in damage and repair[J]. Cells, 2025, 14(12): 918. DOI:10.3390/cells14120918 |
| [23] | Liu Y, Li Y, Zhan MX, et al. Astrocytic cytochrome P450 4A/20-hydroxyeicosatetraenoic acid contributes to angiogenesis in the experimental ischemic stroke[J]. Brain Res, 2019, 1708: 160-170. DOI:10.1016/j.brainres.2018.12.023 |
| [24] | Dwivedi S, Ranjan S, Das S, et al. Role of growth factors and their interplay during oligodendroglial differentiation and maturation[J]. Cytokine Growth Factor Rev, 2025, 84: 47-58. DOI:10.1016/j.cytogfr.2025.07.002 |
| [25] | Wijdicks EFM. Stomaching acute brain injury[J]. Neurocrit Care, 2019, 30(3): 542-545. DOI:10.1007/s12028-019-00685-9 |
| [26] | Xu FH, Sun X, Zhu J, et al. Significance of the gut tract in the therapeutic mechanisms of polydopamine for acute cerebral infarction: neuro-immune interaction through the gut-brain axis[J]. Front Cell Infect Microbiol, 2025, 14: 1413018. DOI:10.3389/fcimb.2024.1413018 |
| [27] | 李军华, 段睿, 李俍, 等. 特立独行的第二脑: 肠神经系统[J]. 生理学报, 2020, 72(3): 382-390. DOI:10.13294/j.aps.2020.0032 |
| [28] | Amarasiri RK, Hyun J, Lee SW, et al. Therapeutic potential of tryptophan metabolite indoleacrylic acid in inflammatory bowel disease: From cellular mechanisms to zebrafish stress-like behavior[J]. Int Immunopharmacol, 2025, 149: 114207. DOI:10.1016/j.intimp.2025.114207 |
| [29] | Liu ZM, Zhang XL, Sun YL, et al. Berberine improves depression-like behaviors and gastrointestinal dysfunction in 6-hydroxydopamine-induced Parkinson's disease rats[J]. Neurogastroenterol Motil, 2025, 37(7): e70033. DOI:10.1111/nmo.70033 |
| [30] | Mathias K, Machado RS, Stork S, et al. Short-chain fatty acid on blood-brain barrier and glial function in ischemic stroke[J]. Life Sci, 2024, 354: 122979. DOI:10.1016/j.lfs.2024.122979 |
| [31] | Arora T, Vanslette AM, Hjorth SA, et al. Microbial regulation of enteroendocrine cells[J]. Med, 2021, 2(5): 553-570. DOI:10.1016/j.medj.2021.03.018 |
| [32] | Yan SC, Ji QP, Ding JL, et al. Protective effects of butyrate on cerebral ischaemic injury in animal models: a systematic review and meta-analysis[J]. Front Neurosci, 2024, 18: 1304906. DOI:10.3389/fnins.2024.1304906 |
| [33] | Singh I, Anand S, Gowda DJ, et al. Caloric restriction mimetics improve gut microbiota: a promising neurotherapeutics approach for managing age-related neurodegenerative disorders[J]. Biogerontology, 2024, 25(6): 899-922. DOI:10.1007/s10522-024-10128-4 |
| [34] | 许媛. 急性胃肠黏膜损伤: 病理生理与治疗[J]. 中华重症医学电子杂志, 2016, 2(1): 16-20. DOI:10.3877/cma.j.jssn.2096-1537.2016.01.005 |
| [35] | Huang CT, Wang YC, Lin SC, et al. Impact of gut microbiota alterations on mitochondrial bioenergetics in cortical astrocytes and sensorimotor impairment in a rat model of lipopolysaccharide-associated encephalopathy[J]. Shock, 2025. DOI:10.1097/SHK.0000000000002637 |
| [36] | Sah RK, Nandan A, Kv A, et al. Decoding the role of the gut microbiome in gut-brain axis, stress-resilience, or stress-susceptibility: a review[J]. Asian J Psychiatry, 2024, 91: 103861. DOI:10.1016/j.ajp.2023.103861 |
| [37] | Sonali S, Ray B, Ahmed Tousif H, et al. Mechanistic insights into the link between gut dysbiosis and major depression: an extensive review[J]. Cells, 2022, 11(8): 1362. DOI:10.3390/cells11081362 |
| [38] | Yousefi B, Babaeizad A, Banihashemian SZ, et al. Gastrointestinal tract, microbiota and multiple sclerosis (MS) and the link between gut microbiota and CNS[J]. Curr Microbiol, 2022, 80(1): 38. DOI:10.1007/s00284-022-03150-7 |
| [39] | Honarpisheh P, Bryan RM, McCullough LD. Aging microbiota-gut-brain axis in stroke risk and outcome[J]. Circ Res, 2022, 130(8): 1112-1144. DOI:10.1161/CIRCRESAHA.122.319983 |
| [40] | Roager HM, Licht TR. Microbial tryptophan catabolites in health and disease[J]. Nat Commun, 2018, 9(1): 3294. DOI:10.1038/s41467-018-05470-4 |
| [41] | Checa-Ros A, Jeréz-Calero A, Molina-Carballo A, et al. Current evidence on the role of the gut microbiome in ADHD pathophysiology and therapeutic implications[J]. Nutrients, 2021, 13(1): 249. DOI:10.3390/nu13010249 |
| [42] | Welathanthree M, Keating DJ, Macefield VG, et al. Cross-talk between microbiota-gut-brain axis and blood pressure regulation[J]. Clin Sci (Lond), 2025, 139(9): 431-447. DOI:10.1042/CS20240787 |
| [43] | Su JQ, Effat K, Ding MY, et al. Polysaccharide from Gynostemma pentaphyllum makino modulates the oxidative stress response under an acute hypobaric hypoxia environment by enhancing the relative abundance of anti-inflammatory gut microbiota[J]. J Agric Food Chem, 2025, 73(24): 15027-15045. DOI:10.1021/acs.jafc.5c00178 |
| [44] | Hu QY, Ren HJ, Hong ZW, et al. Early enteral nutrition preserves intestinal barrier function through reducing the formation of neutrophil extracellular traps (NETs) in critically ill surgical patients[J]. Oxid Med Cell Longev, 2020, 2020: 8815655. DOI:10.1155/2020/8815655 |
| [45] | Guo P, Xue YD, Zhang D, et al. Network pharmacology to unveil the mechanism of berberine in the treatment of Streptococcus suis meningitis in humans and pigs[J]. Toxics, 2025, 13(2): 138. DOI:10.3390/toxics13020138 |
| [46] | Cai XX, Cai XH, Xie QH, et al. NLRP3 inflammasome and gut microbiota-brain axis: a new perspective on white matter injury after intracerebral hemorrhage[J]. Neural Regen Res, 2026, 21(1): 62-80. DOI:10.4103/NRR.NRR-D-24-00917 |
| [47] | Ting TY, Lee WJ, Goh HH. Molecular genetics and probiotic mechanisms of Saccharomyces cerevisiae var. boulardii[J]. Probiotics Antimicrob Proteins, 2025. DOI:10.1007/s12602-025-10634-y.[PublishedonlineJuly24,2025 |
| [48] | Ghaemi M, Kheradmand D. The gut-brain axis in traumatic brain Injury: Literature review[J]. J Clin Neurosci, 2025, 136: 111258. DOI:10.1016/j.jocn.2025.111258 |
| [49] | Eslami M, Adampour Z, Fadaee Dowlat B, et al. A novel frontier in gut-brain axis research: the transplantation of fecal microbiota in neurodegenerative disorders[J]. Biomedicines, 2025, 13(4): 915. DOI:10.3390/biomedicines13040915 |
 2025, Vol. 34
2025, Vol. 34