多种损伤因素导致的多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)和全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)发生过程中,肺脏是极易受炎症介质损伤的靶器官,肺微血管内皮细胞(PMVEC)损伤出现较早且较为严重,肿瘤坏死因子-α(TNF-α)、脂多糖、凝血酶等多种炎症介质引起PMVEC通透性增高,绝大多数是通过内皮细胞肌动蛋白细胞骨架的改变,内皮细胞发生收缩,细胞间隙增大,通透性增高。埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)作为细胞骨架连接蛋白,调控着细胞骨架的解聚和重排,在维持内皮屏障功能中起重要作用[1, 2, 3, 4],Rho激酶(ROCK)可能在炎症介质诱导的内皮通透性增高中起主要的信号转导作用[5],因此,研究ERM蛋白在肺血管内皮细胞通透性的功能变化及相关调控机制具有重要意义。本实验通过体外培养大鼠PMVEC,用Western印迹方法检测TNF-α诱导大鼠PMVEC后p-ERM表达变化,并初步探讨ROCK是否参与ERM蛋白磷酸化的调控。
1 材料与方法 1.1 实验动物及主要材料
(1)动物:健康雄性、体质量100~120 g、SPF级SD大鼠购自安徽省实验动物中心[合格证号:SCXK(皖)2011-002]。(2)材料:Dulbecco改良Eagle高糖培养基干粉(DMEM)及胎牛血清(美国Hyclone公司);兔抗鼠ERM多克隆抗体、兔抗鼠P-ERM多克隆抗体(美国Cell signal公司);ROCK抑制剂Y-27632(上海Selleckchem公司);辣根过氧化物酶标记的羊抗兔IgG(武汉博士德生物工程有限公司);底物化学发光检测试剂盒(美国Pierce公司)。
1.2 大鼠PMVEC分离培养及鉴定
参照本实验室及参考文献建立的实验方法进行[6, 7, 8]:取体质量约100~120 g、健康雄性、SPF级SD大鼠1只,10%的水合氯醛(300 mg/kg)腹腔内注射麻醉,同时给予普通肝素钠3 kU抗凝。大鼠仰面固定消毒,手术器械逐层剪开胸腔,双侧颈动脉切断放血活杀,经右心灌注50 mL DMEM液体,取出肺脏置DMEM培养液中。以下操作在超净工作台进行。充分漂洗肺组织后,用眼科剪去除脏层胸膜,取表面肺组织条,切成1 mm3大小的组织块,将小组织块均匀种植在培养瓶中,间距1 cm,倒置放在孵箱2 h,后加入少量含15%FBS的DMEM培养液,将培养瓶置于37 ℃、5% 二氧化碳、湿度为95%~100%的孵箱内培养60 h后去除组织块。3~4 d换液一次,倒置显微镜下观察。当培养至细胞单层80%~90%汇合时,用0.25%的胰蛋白酶消化并按1∶ 1传代,第2代细胞用于细胞鉴定,第3代细胞用于本实验。 1.3 Western印迹检测PMVEC表达ERM蛋白、p-ERM蛋白
RIPA裂解液裂解第3代PMVEC后,收集细胞蛋白。10%分离胶和5%积层胶进行蛋白电泳,蛋白转至硝酸纤维素膜上,5%脱脂牛奶封闭,兔抗鼠ERM多克隆抗体(稀释浓度为1∶ 800)4 ℃孵育过夜,辣根过氧化物酶标记的羊抗兔IgG溶液(稀释浓度为1∶ 20 000)室温孵育1 h,底物化学发光检测法显影,扫描仪扫描存盘。
1.4 统计学方法
采用SPSS 16.0软件进行统计分析,计量资料以均数±标准差(x ±s)表示,多组变量间比较采用单因素方差分析,以P< 0.05为差异具有统计学意义。。
2 结果 2.1 不同浓度TNF-α对PMVEC表达ERM蛋白、p-ERM的影响
PMVEC中p-ERM相对表达量随TNF-α孵育浓度的增加(0,0.1,1,10 μg/L)而逐渐升高,其中10 μg/L的TNF-α孵育60 min组的p-ERM表达最高,各组间差异均有统计学意义(均P=0.000),见图 1。
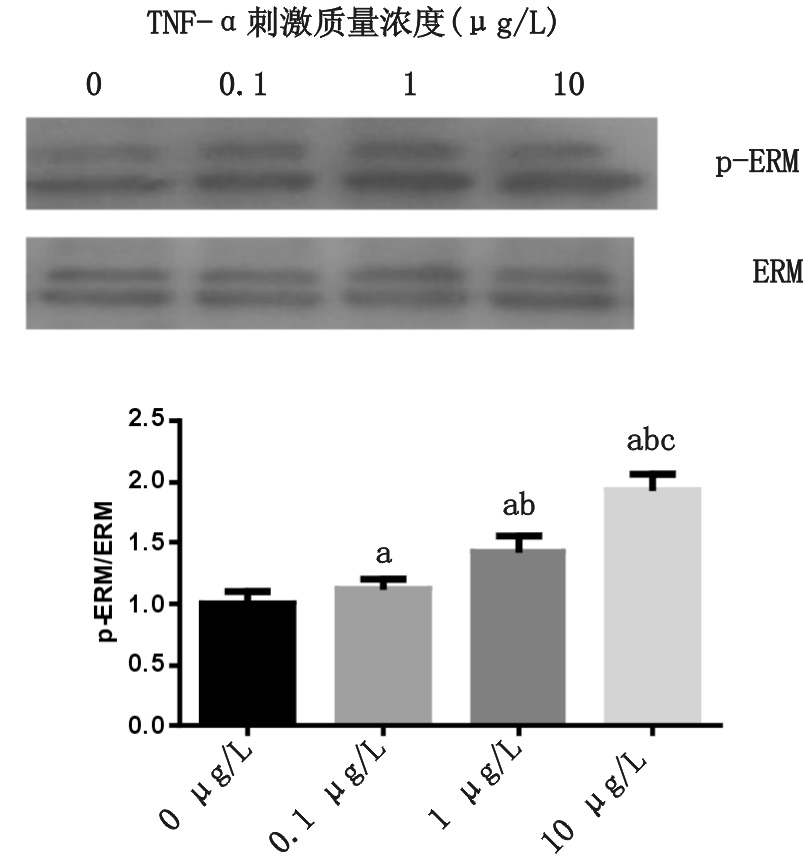 |
| 与正常对照组比较,aP< 0.05;与TNF-α 0.1 μg/L组比较,bP< 0.05;与TNF-α 1 μg/L组比较,cP< 0.05 图 1 不同质量浓度TNF-α刺激PMVEC中p-ERM的表达变化 Fig 1 Expression of p-ERM proteins in PMVEC stimulated by different concentrations of TNF-α |
10 μg/L TNF-α与PMVEC共同孵育后,ERM总蛋白表达无明显变化;与TNF-α刺激0 min比较,p-ERM相对表达量于15 min开始升高(P=0.004),90 min达高峰(P=0.000),随后逐渐下降,TNF-α刺激180 min时仍维持较高水平(P=0.016),见图 2。
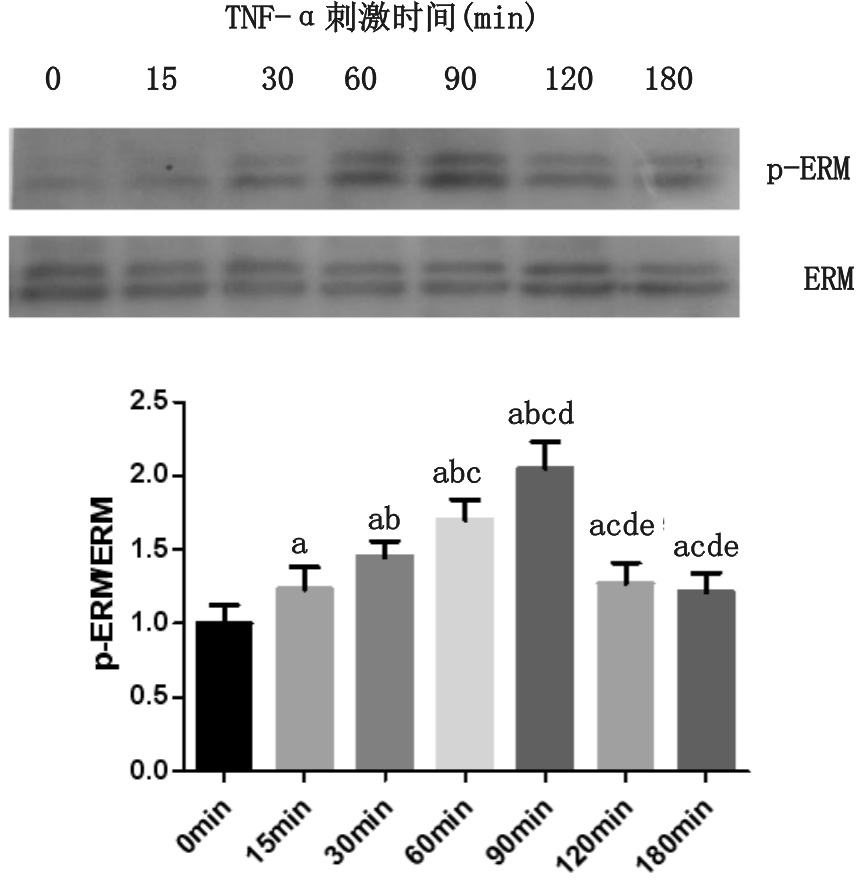 |
| 与TNF-α 0 min比较,aP< 0.05;与TNF-α 15 min比较,bP< 0.05;与TNF-α 30 min比较,cP< 0.05;与TNF-α 60 min比较,dP< 0.05;与TNF-α 90 min比较,eP< 0.05 图 2 TNF-α时间依赖性刺激PMVEC 表达p-ERM Fig 2 Expression of p-ERM proteins in time-dependent manner in PMVEC stimulated by TNF-α |
30 μmol/L Y-27632预处理大鼠PMVEC 1 h 后,再加入10 μg/L TNF-α刺激,p-ERM相对表达量较10 μg/LTNF-α单独刺激组显著减少(P=0.002);与未处理组和单独ROCK抑制剂比较,p-ERM相对表达量差异无统计学意义(P=0.900,P=0.973),见图 3。
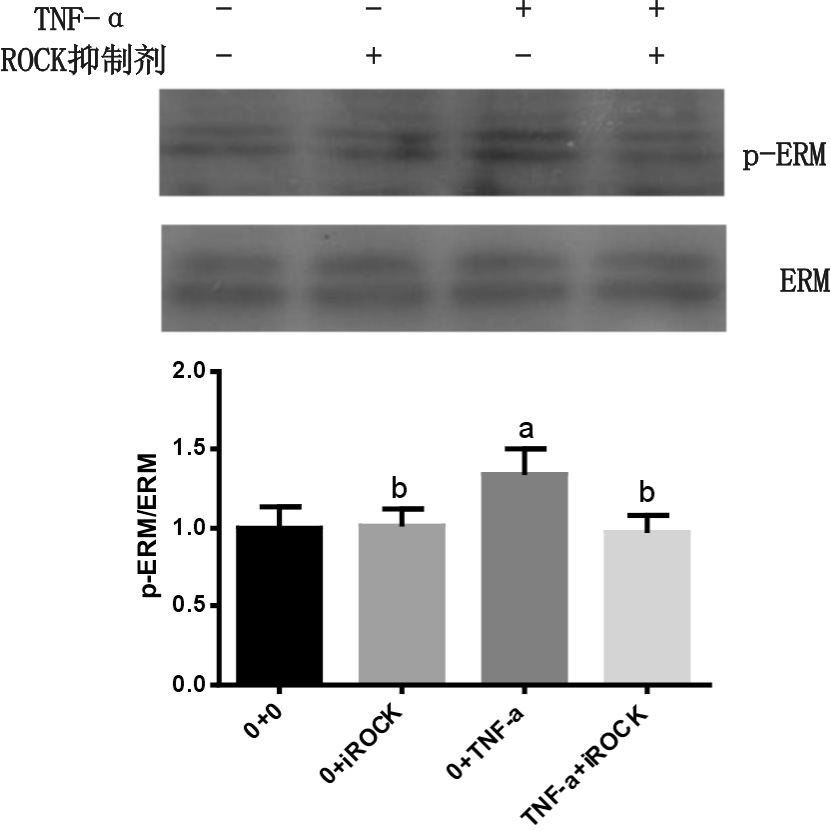 |
| 与未处理组比较,aP< 0.05;与TNF-α组比较,bP< 0.05 图 3 ROCK抑制剂对TNF-α致PMVEC中p-ERM表达的影响 Fig 3 Effects of the ROCK inhibitor on the expression of p-ERM proteins of PMVEC induced by TNF-α |
肺内炎症反应的失控导致肺微血管内皮细胞通透性增高是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的病理基础,多种炎症介质均可引起肺微血管内皮细胞(PMVEC)通透性增加,其中TNF-α是引起ARDS最关键的炎症因子之一,PMVEC是TNF-α作用的主要靶细胞,当TNF-α损伤PMVEC时,细胞骨架重排,细胞回缩,细胞间隙形成,内皮细胞通透性增高[7, 8, 9]。因此,细胞骨架重排与内皮屏障功能紊乱密切相关,是引起肺微血管通透性增高的重要机制,研究细胞骨架相关蛋白在内皮屏障中的功能对寻找防治ARDS的有效措施具有深远意义。
埃兹蛋白-根蛋白-膜突蛋白是一种广泛存在于真核细胞胞浆中的细胞骨架连接蛋白,在结构上均由高度同源的N端、中间的alpha-螺旋和带有高电荷的C端构成;非活化状态下,ERM蛋白的N端和C端相互覆盖,抑制ERM蛋白与其受体相结合,其活化主要是通过C端苏氨酸位点(Ezrin Thr-567、Moesin Thr-558、Radixin Thr-564)磷酸化,磷酸化的ERM蛋白N端和C端首尾断开,从而ERM蛋白通过N端与膜相关蛋白和或通过C端与F-actin相连接而起桥梁作用[10, 11, 12, 13, 14, 15]。研究表明,ERM蛋白与膜蛋白或肌动蛋白结合不仅仅限于结构上,而且表现在功能上,即ERM蛋白通过与信号转导分子相互作用激活相应效应分子如蛋白磷酸化从而发挥不同的生物学功能。
本实验应用TNF-α体外刺激大鼠PMVEC,观察到磷酸化的ERM蛋白(p-ERM)表达明显上调,并在一定程度上呈时间和剂量依赖关系;10 μg/L TNF-α刺激下,p-ERM表达于15 min开始升高,90 min达高峰,后逐渐下降但仍高于正常对照组;本课题组既往报道TNF-α作用大鼠PMVEC 30 min时单层通透性明显增高,至60 min达峰值,且通透性增高到峰值时内皮细胞骨架发生重排,提示p-ERM可能在TNF-α致PMVEC单层屏障功能紊乱过程中起重要作用[9]。Koss等[1]观察了TNF-α诱导的人PMVEC通透性增高过程中p-ERM表达变化的影响:TNF-α作用于内皮细胞30 min时p-ERM表达无明显变化,于60 min表达显著增加,之后渐平稳;与本实验结果相比较,p-ERM在内皮细胞表达变化的时间差异性可能由于不同组织和器官的血管内皮细胞存在异质性,对炎症刺激和细胞因子的反应也不尽相同。
大量研究表明,Rho/ROCK信号通路作用于细胞骨架或其靶蛋白后,诱发肌动蛋白细胞骨架重排、调控基因转录等,引起细胞收缩增强和通透性增加;研究证实,Rho/ROCK信号通路在TNF-α诱导的PMVEC通透性增高过程中被激活,抑制ROCK信号分子可明显抑制肌球蛋白轻链(MLC)磷酸化,内皮细胞单层通透性降低[5, 7],表明Rho/ROCK信号通路在TNF-α致PMVEC通透性增高过程中起着十分重要的作用。有报道ROCK可体外磷酸化ERM蛋白,然而,目前尚未见有关ROCK在TNF-α诱导PMVEC损伤过程中对ERM蛋白磷酸化表达变化的影响。因此,本实验进一步探讨了ROCK对TNF-α诱导体外大鼠PMVEC中p-ERM表达变化的调控。目前,ROCK分为ROCK1和ROCK2亚型,Mong和Wang等[5]研究在TNF-α诱导PMVEC通透性增高模型中,ROCK1和ROCK2均活化,而ROCK1的活化主要对TNF-α致PMVEC通透性增高早期(5~180 min)起关键作用。结合前面实验结果观察到p-ERM表达于TNF-α作用15 min开始升高,90 min达高峰,因此笔者选用特异性ROCK1抑制剂(Y-27632),笔者观察到应用Y-27632抑制ROCK活性后p-ERM表达明显下调,提示ROCK参与了ERM蛋白的磷酸化,可能在TNF-α致体外大鼠PMVEC 损伤过程中起积极作用,在一定程度上为从细胞骨架重新分布的信号转导机制中提供了切入点;然而ROCK是否可能通过磷酸化ERM蛋白这一途径进而引起细胞骨架重排尚有待进一步研究。
ERM蛋白对内皮细胞的形态和功能的影响尚不完全清楚,有报道用RNA干扰技术沉默ERM蛋白表达明显抑制细胞骨架解聚和重排,内皮细胞通透性显著降低[1, 2],但也有报道沉默ERM蛋白可减弱神经鞘氨醇-1-磷酸诱导的内皮屏障增强功能[3],提示ERM蛋白在内皮屏障功能机制的调控中发挥不同作用。
总之,本研究证实体外培养大鼠原代PMVEC表达ERM蛋白,TNF-α刺激诱导PMVEC表达磷酸化的ERM蛋白,抑制ROCK可显著抑制TNF-α对PMVEC表达p-ERM蛋白的刺激效应,从而为进一步研究ERM蛋白的功能、信号转导途径和调节机制提供了理论依据。
| [1] | Koss M, Pfeiffer GR, Wang Y, et al. Ezrin/Radixin/Moesin proteins are phosphorylated by TNF-α and modulate permeability increases in human pulmonary microvascular endothelial cells[J]. J Immunol, 2006, 176(2): 1218-1227. |
| [2] | Guo X, Wang L, Chen B, et al. ERM protein moesin is phosphorylated by advanced glycation end products and modulates endothelial permeability[J]. Am J Physiol Heart Circ Physiol, 2009, 297(1): H238-246. |
| [3] | Adyshev DM, Moldobaeva NK, Elangovan VR, et al. Differential involvement of ezrin/radixin/moesin proteins in sphingosine 1-phosphate-induced human pulmonary endothelial cell barrier enhancement[J]. Cell Signal, 2011, 23(2): 2086-2096. |
| [4] | Adyshev DM, Dudek SM, Moldobaeva N, et al. Ezrin/radixin/moesin proteins differentially regulate endothelial hyperpermeability after thrombin[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(3): 240-255. |
| [5] | Mong PY, Wang Q. Activation of Rho kinase isoforms in lung endothelial cells during inflammation[J]. J Immunol, 2009, 182(4): 2385-2394. |
| [6] | 孙耕耘, 王应灯. G蛋白偶联受体激酶2参与血小板活化因子致肺微血管内皮细胞损伤的机制[J]. 中华急诊医学杂志, 2004, 13(9): 602-605. |
| [7] | Shah NG, Tulapurkar ME, Damarla M, et al. Activation of Rho kinase by TNF-α is required for JNK activation in human pulmonary microvascular endothelial cells[J]. J Immunol, 2008, 180(1): 550-558. |
| [8] | 尤青海, 孙耕耘, 高磊, 等. Src抑制的蛋白激酶C底物调控内皮细胞分泌TNF-α[J]. 中华急诊医学杂志, 2012, 21(12): 1349-1353. |
| [9] | 肖贞良, 孙耕耘, 夏前明, 等. 肿瘤坏死因子致肺微血管内皮细胞单层通透性损伤的实验研究[J]. 中国应用生理学杂志, 2001, 17(1):79-81. |
| [10] | Fehon RG, McClatchey AI, Bretscher A. Organizing the cell cortex: the role of ERM proteins[J]. Nat Rev Mol Cell Biol, 2010, 11(4): 276-287. |
| [11] | Moleirinho S, Tilston AL, Angus L, et al. The expanding family of FERM proteins[J]. Biochem J, 2013, 452(2): 183-193. |
| [12] | Hughes SC, Fehon RG. Understanding ERM proteins-the awesome power of geneticsnally brought to bear[J]. Curr Opin Cell Biol, 2007, 19(1): 51-56. |
| [13] | Valderrama F, Thevapala S, Ridley AJ, et al. Radixin regulates cell migration and cell-cell adhesion through Rac1[J]. J Cell Sci, 2012, 125(14):3310-3319. |
| [14] | Neisch AL, Fehon RG. Ezrin,Radixin and Moesin: key regulators of membrane-cortex interactions and signaling[J]. Curr Opin Cell Biol, 2011, 23(4): 377-382. |
| [15] | Clucas J, Valderrama F. ERM proteins in cancer progression[J]. J Cell Sci, 2014, 127(2): 267-275. |
 2015, Vol. 24
2015, Vol. 24




