2 福建省立医院重症二科,福州 350001;
3 福建中医药大学附属人民医院急诊科,福州 350004
脓毒症的发病率高、死亡率高[1-2]。因此进一步探讨脓毒症相关机制显得必要。脾脏为机体的重要免疫器官,在免疫调节中作用显著[3]。因此,本研究拟采RNA-seq技术分析脓毒症脾功能障碍可能的机制,以期指导脓毒症治疗。
1 材料与方法 1.1 动物模型制备与分组健康雄性Wistar大鼠30只,体质量(200±20) g,购自上海斯莱克实验动物有限公司。随机(随机数字法)分成2组,即对照组、脓毒症组,每组15只。实验前正常饮食、饮水。脓毒症组大鼠采用盲肠结扎穿孔术(CLP)构建模型[4];对照组只开腹、关腹,不进行CLP。各组术后肌注平衡液5 mL/kg。术后正常饮食、饮水。
1.2 脾脏组织标本的采集术后24 h、48 h每组分别随机(随机数字法)取5只,麻醉后取部分脾脏标本(每组取3只,做病理检查),部分组织行RNAseq检测。
1.3 数据生物信息学分析转录谱的生物信息学分析:差异表达基因的筛选,聚类分析、GO分析、pathway分析等
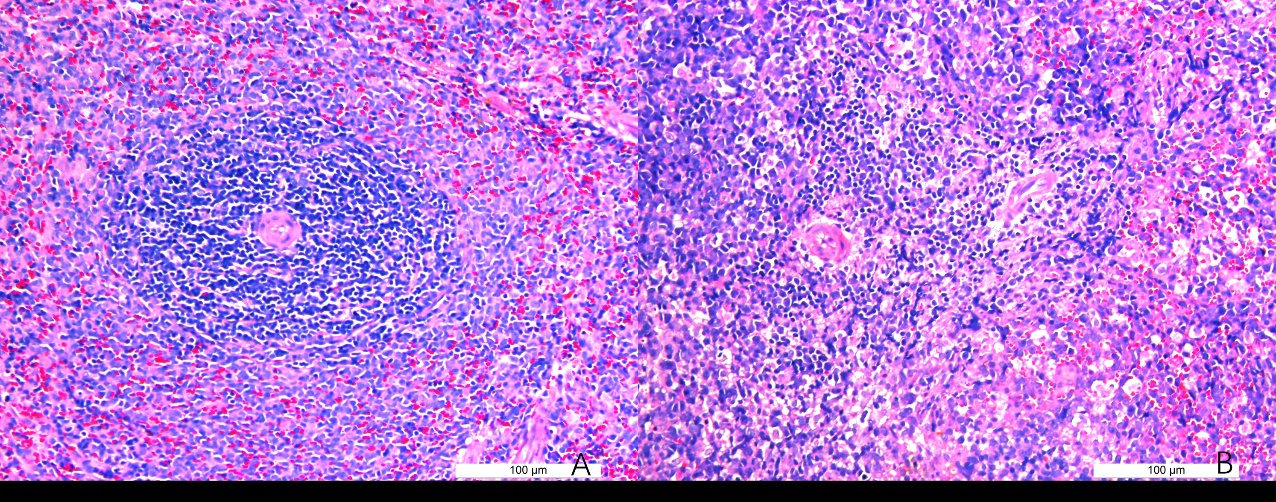
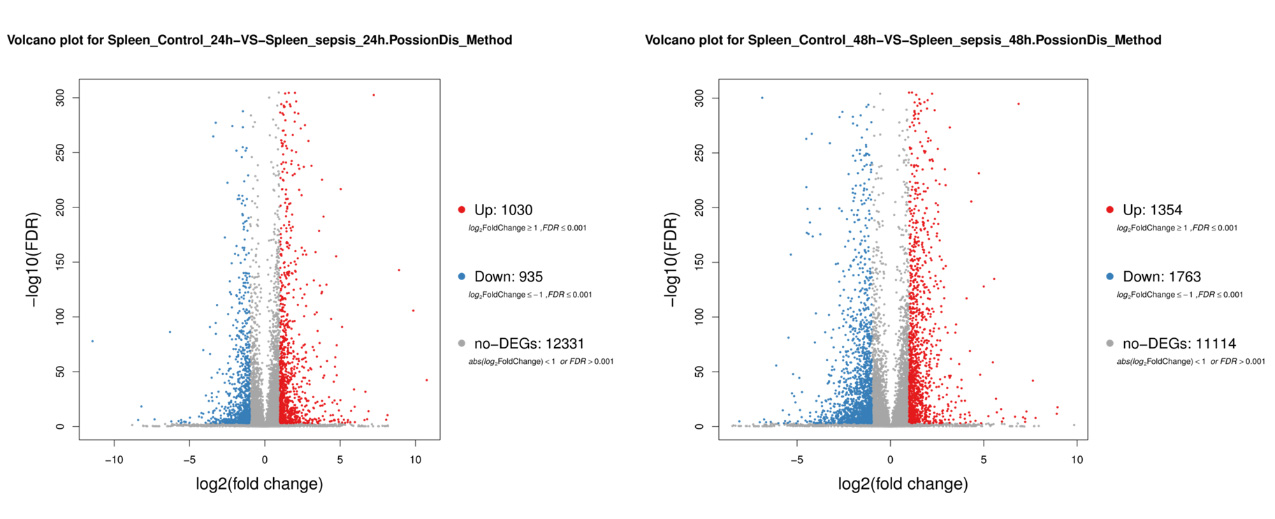
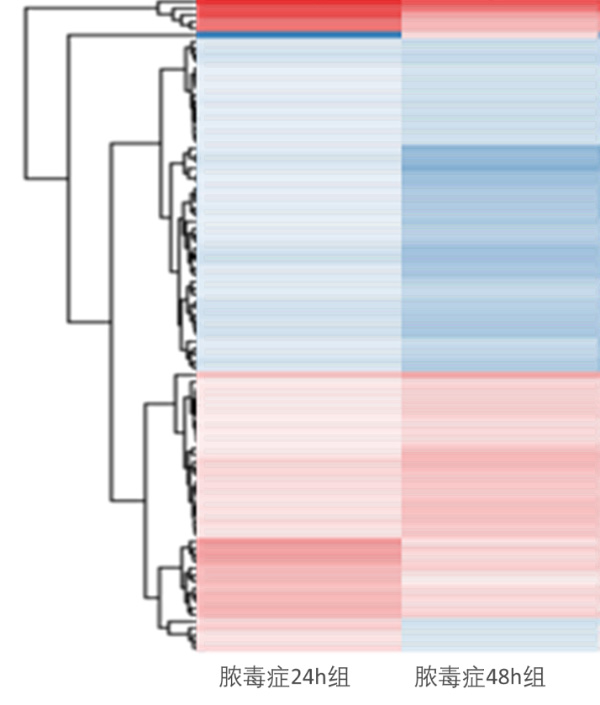
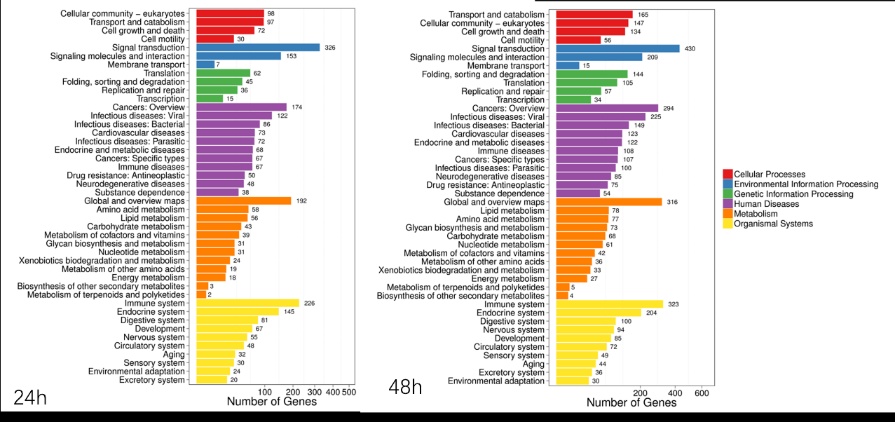
2 结果48 h各组病理结果,对照组脾组织结构正常(见图 1A )。脓毒症组脾组织见白髓结构破坏,红白髓交界模糊,多量组织细胞浸润,红髓充血(见图 1B)。差异mRNA的Volcano-plot分布图(见图 2)。相比于对照组,24 h时脓毒症组脾组织mRNA表达上调的有1 030个,下调的有935个[5];48 h组表达上调的有1 354个,下调的有1 763个。差异mRNA的聚类情况(见图 3)。GO功能分类结果(见图 4)。脓毒症大鼠脾组织部分通路相关基因表达情况(见图 5、6):脓毒症大鼠24 h,48 h脾组织关于细胞因子及其受体相互作用通路相关基因的分布图(见图 7,图 8)。脓毒症大鼠24 h,48 h脾组织关于细胞凋亡相关通路的基因分布图(见图 9,图 10)。
|
| 图 1 正常大鼠及脓毒症组大鼠48 h脾组织病理切片图 |
|
|
|
| 注:DEG:差异表达基因;:X轴:log2转换后的差异倍数值,Y轴:-log10转换后的显著性值。红色:上调的DEG,蓝色:下调的DEG,灰色:非DEG 图 2 DEG的Volcano-plot分布图 |
|
|
|
| Y轴:差异基因。颜色:差异倍数(红色:↑,蓝色:↓,颜色越深倍数越大) 图 3 差异mRNA聚类情况 |
|
|
|
| 图 4 脓毒症大鼠24 h、48 h脾组织mRNA GO功能分类结果 |
|
|
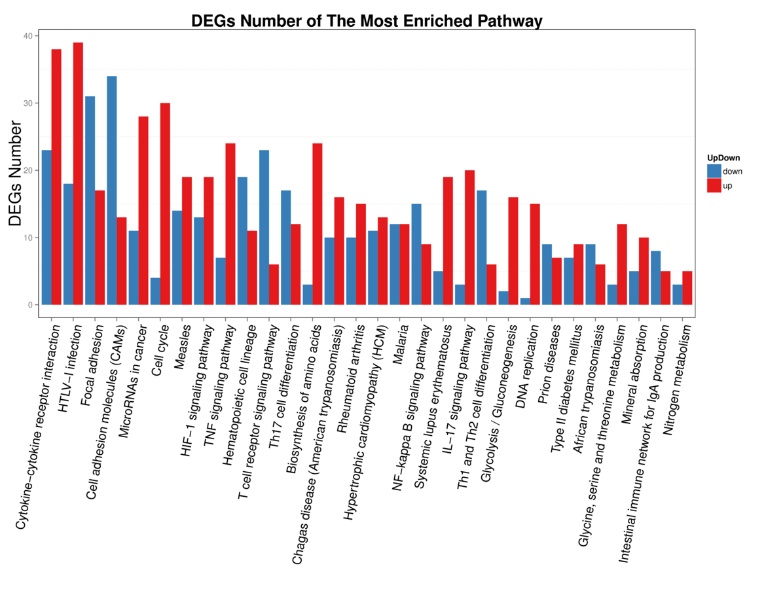
|
| X轴:GO功能分类,Y轴:对应GO Term中的基因数。 图 5 脓毒症大鼠24 h组 |
|
|
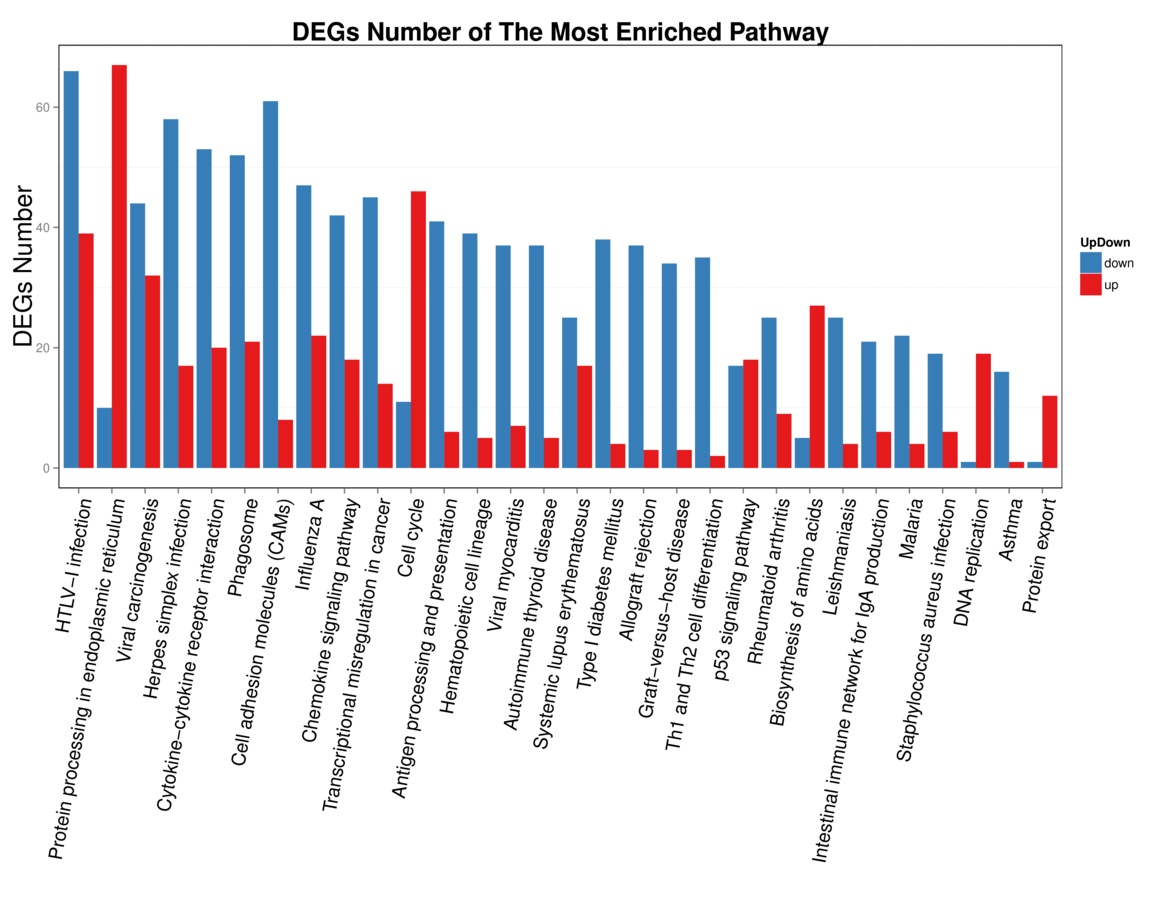
|
| 图 6 脓毒症大鼠48 h组 |
|
|
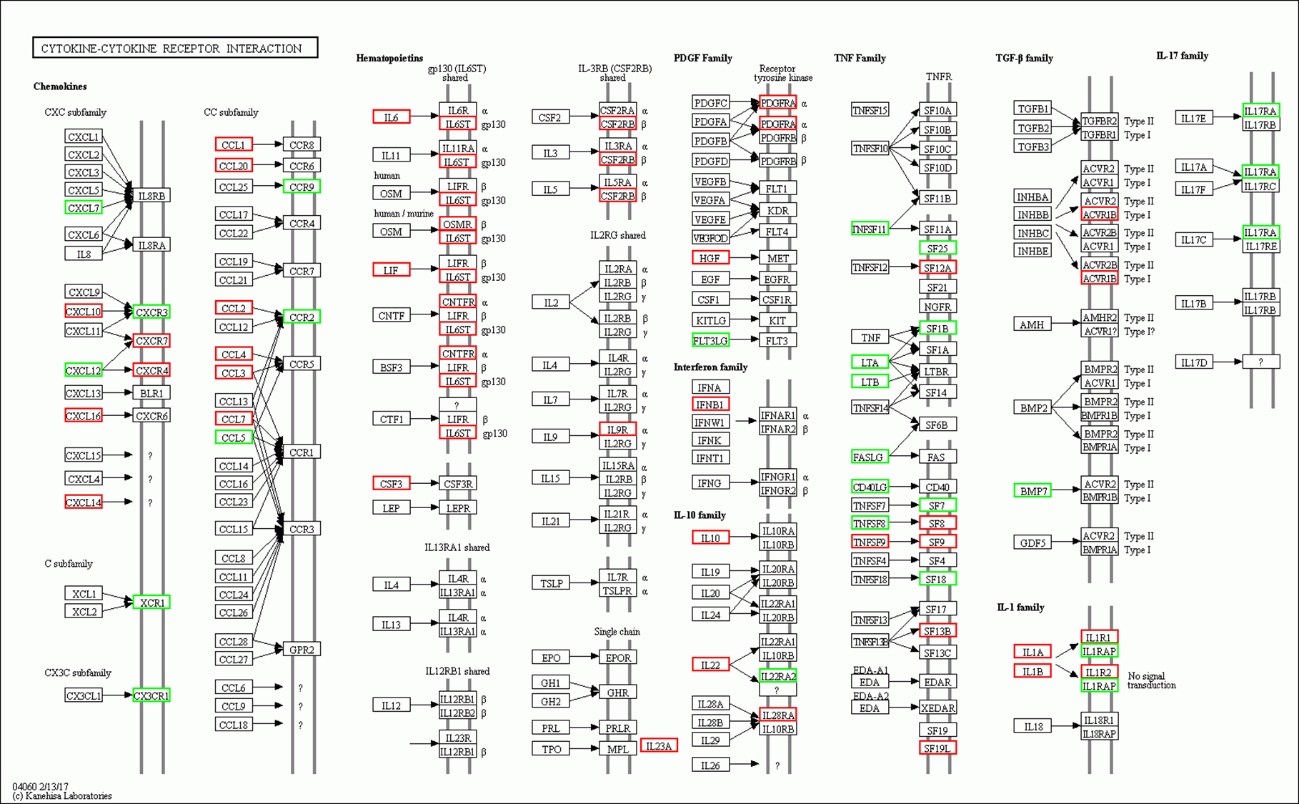
|
| 注:红色:上调基因,绿色:下调基因。 图 7 脓毒症大鼠24 h组 |
|
|
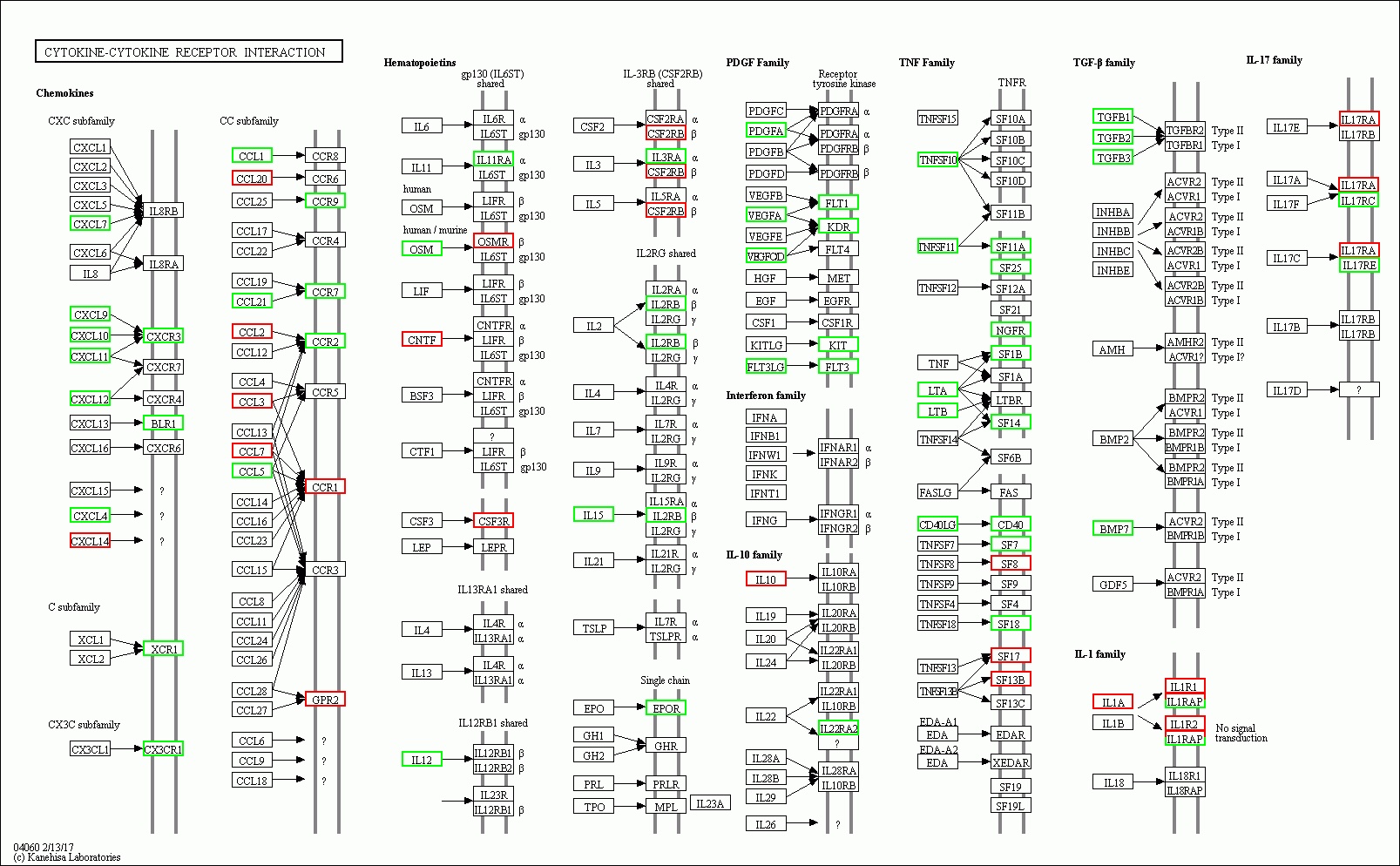
|
| 图 8 脓毒症大鼠48 h组 |
|
|
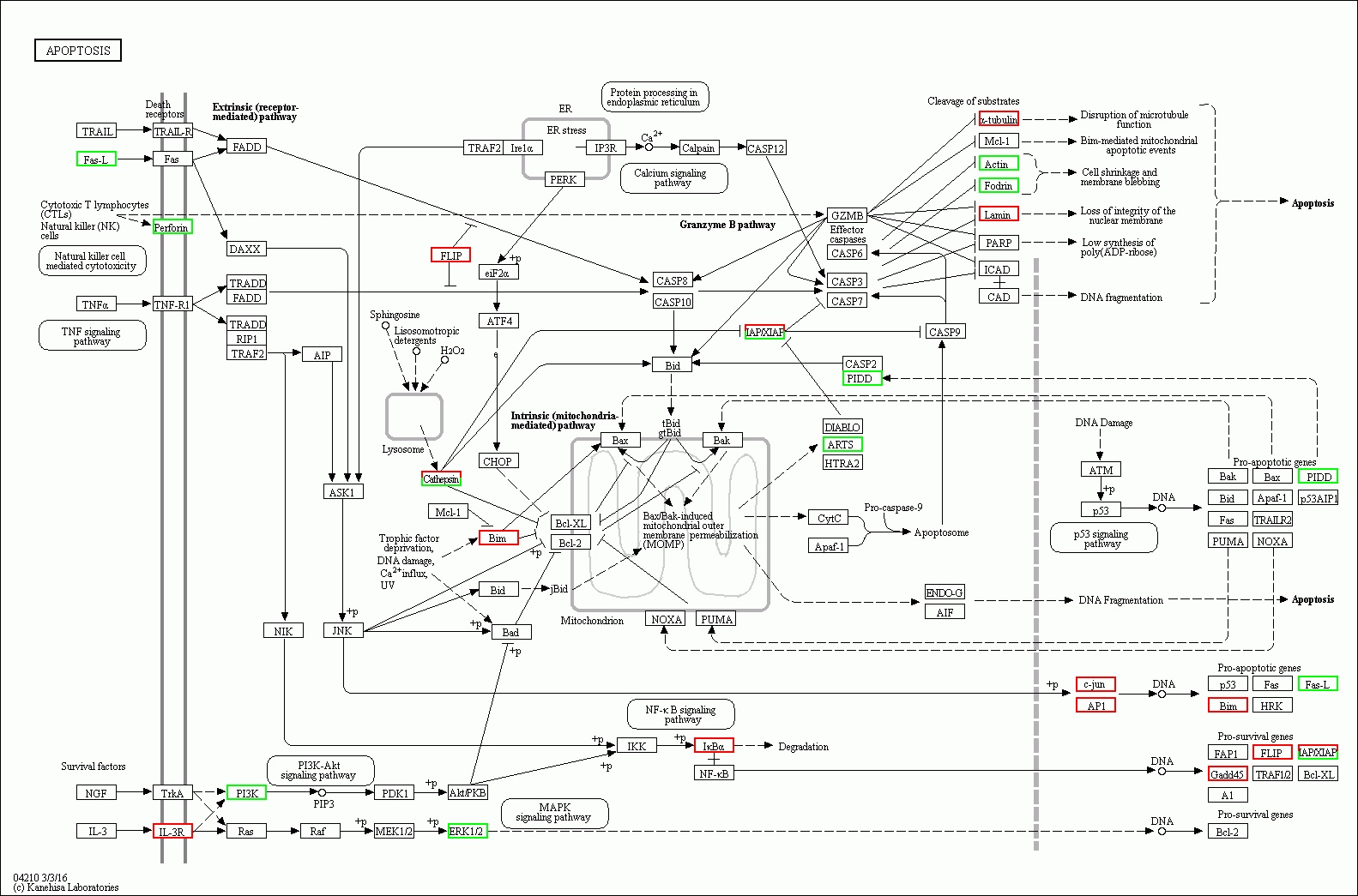
|
| 图 9 脓毒症大鼠24 h组 |
|
|
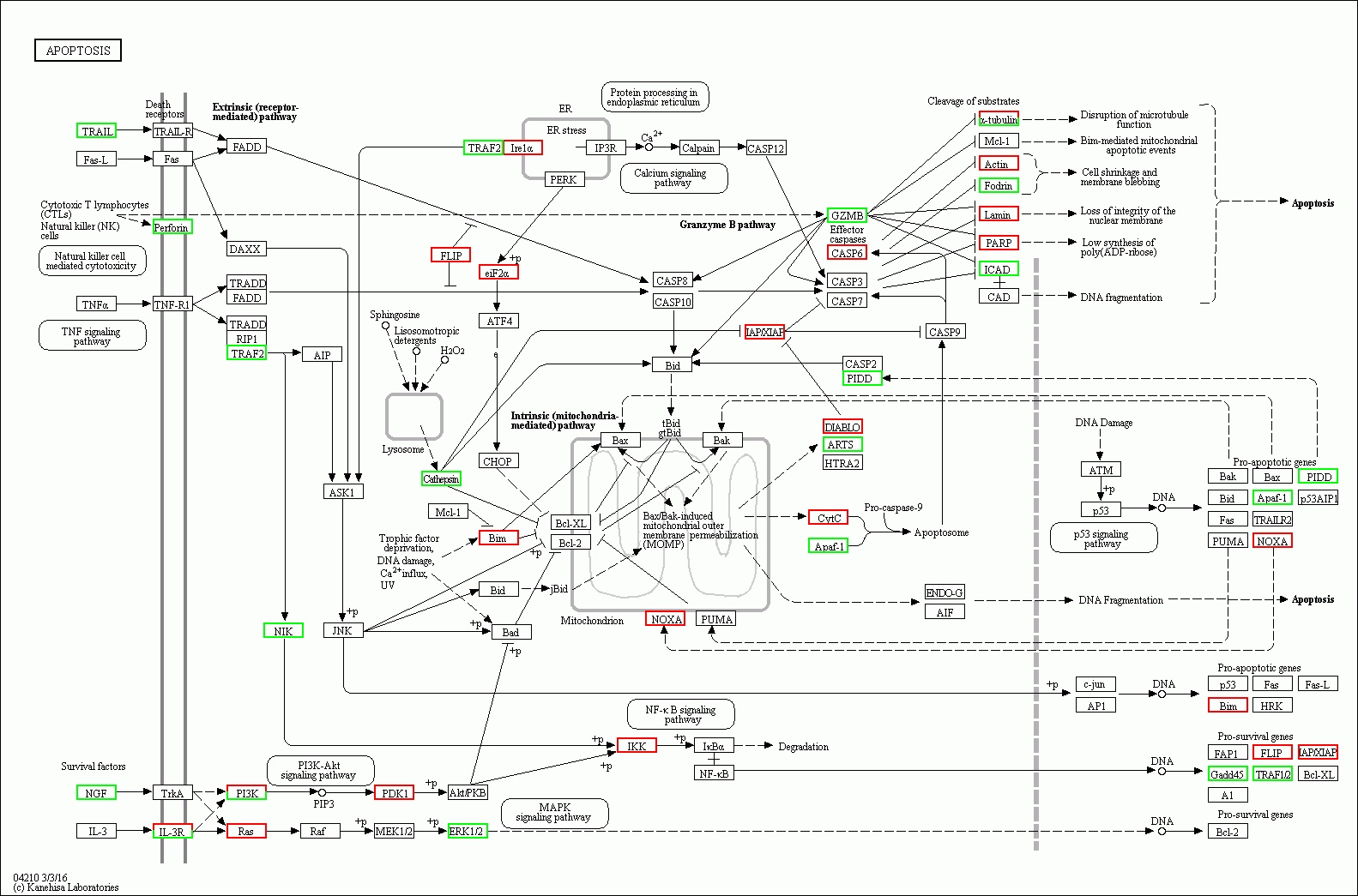
|
| 图 10 脓毒症大鼠48 h组 |
|
|
早期过度炎症反应、晚期免疫抑制系脓毒症的重要机制之一[6-7]。脾脏为人体免疫器官,在血源性抗原出现时,负责启动免疫反应[9]。脓毒症时SIRS反应可引起脾功能障碍[10]。本研究发现脓毒症48 h大鼠脾组织白髓结构破坏,红白髓交界模糊,其结构改变可能影响其免疫功能。既往对脓毒症大鼠24 h采用基因芯片分析发现部分基因表达异常[11]。若能进一步研究其早晚期的相关基因表达变化也许对脓毒症脾功能障碍有进一步的诠释。本研究采用RNA-seq技术对脓毒症大鼠早晚期脾组织行mRNA检测,是既往研究的深入,发现脓毒症早期组脾组织基因上下调数远少于晚期组,如脓毒症24 h组脾组织mRNA上调数1 030个,下调数935个,而48 h组mRNA上调数1 354个,下调数1 763个,差异明显(见图 2),符合疾病的发展过程。从图 3看,脓毒症24 h、48 h部分区域从红色趋于变浅甚至变蓝,浅蓝趋于蓝色,直观的反应脓毒症时脾脏基因表达量变化情况。从GO功能分类结果(图 4)得知,cellular processes、Environmental informationProcessing、Genetic Information Processing、Human Diseases、Metabolism、Organismal Systems相关功能基因随时间发展出现差异表达数为上升趋势。进而我们对其分析发现,脓毒症早晚期脾mRNA出现变化主要涉及细胞因子与其受体相互作用、IL-17、T细胞受体、TH1、TH2细胞分化、TNF、Toll受体、凋亡等相关信号通路。研究显示,脓毒症晚期免疫抑制可能是脓毒症患者死亡的主要原因,免疫治疗可能是未来一大趋势[12-15]。本文拟从炎症反应与细胞凋亡相关通路来阐述脓毒症脾功能障碍的相关机制。
(1)细胞与其受体相互作用信号通路相关的基因表达上调数明显减少,部分甚至转为下调。从图 7、8可以看出脓毒症大鼠24 h脾组织mRNA表达上调,而48 h转为下调的有2个:CXCL10、CCL1;从上调转为正常表达的有22个:CXCL16、CNTFR、IL9R、IL23A、HGF、IFNB1、IL22、PDGFRA、IL28RA、TNFSF9、SF12A、SF9、SF19L、IL1β、ACVR1B、CXCR7、CXCR4、IL6、LIF、CSF3、IL6ST、CCL4。从正常表达转为下调的有30个:CXCL9、CXCL11、CXCL4、CCL21、CCR7、OSM、IL12、IL11RA、IL15、IL3RA、IL2RB、EPOR、PDGFA、VEGFA、VEGFOD、FLT1、KDR、KIT、FLT3、TNFSF10、SF11A、NGFR、SF14、CD40、TGFB1、TGFB2、TGFB3、IL17RC、IL17RE、BLR1。而从表达下调转为上调的仅一个:IL17RA,从下调转为正常表达的仅2个:FASLG、TNFSF8,从正常表达转为上调的有10个:CCR1、GPR2、CNTF、CSF3R、SF8、SF17、SF13B、IL1A、IL1R1、IL1R2。从中可以看出脓毒症早期细胞因子与其受体相关基因表达以上调为主,脓毒症晚期则相反,部分基因转为下调,部分基因转为正常表达,多数正常表达基因在晚期出现表达下调符合脓毒症早期过度炎症反应、晚期免疫抑制的观点。
(2)脓毒症晚期脾组织相关细胞的凋亡系脓毒症晚期脾功能障碍的原因之一。从图 9-10可以看出,在细胞凋亡相关通路中,脓毒症大鼠24 h脾组织mRNA表达上调,48 h表达下调有1个:Gadd45。24 h表达上调,而48 h正常表达的基因有5个:IL-3R、IκBα、a-tubulin、c-jun、AP1。24 h正常表达,而48 h转为表达下调的基因有9个:TRAIL、NGF、TRAF2、NIK、Cathepsin、GZMB、ICAD、Apaf-1、TRAF1/2。24 h正常表达,而48h转为表达上调的基因有10个:Ras、PDK1、Irelα、eiF2α、IKK、CASP6、DLABLO、CytC、PARP、NOXA。脓毒症大鼠24 h脾组织mRNA表达下调,而48 h转为表达上调的基因有1个:Actin。24 h表达下调转为正常表达的有1个:fas-L。脓毒症晚期大鼠脾组织细胞凋亡相关通路中的基因表达紊乱,可能是晚期脾功能障碍的原因之一,特别是胞膜空泡化相关基因Actin从下调转为上调,促凋亡相关基因NOXA从正常表达转为上调,促生存基因Gadd45从表达上调转为下调,促生存基因TRAF1/2从正常表达转为下调直接促进相关细胞的凋亡。
综上所述,早期过度炎症反应、晚期免疫抑制是脓毒症重要机制之一。其机制可能跟细胞因子与其受体相互作用、凋亡通路相关基因表达有关。若能使脓毒症晚期脾组织细胞因子与其受体相互作用相关基因免受广泛抑制,同时调控凋亡通路中部分关键基因的紊乱表达,可能对脓毒症晚期的免疫抑制有一定的改善作用。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0287 |
| [2] | Ranzani OT, Shankar-Hari M, Harrison DA, et al. A Comparison of mortality from sepsis in Brazil and England[J]. Crit Care Med, 2019, 47(1): 76-84. DOI:10.1097/CCM.0000000000003438 |
| [3] | Mebius RE, Kraal G. Structure and function of the spleen[J]. Nat Rev Immunol, 2005, 5(8): 606-616. DOI:10.1038/nri1669 |
| [4] | Hubbard WJ, Choudhry M, Schwacha MG, et al. Cecal ligation and puncture[J]. Shock, 2005, 24(Suppl 1): 52-57. DOI:10.1097/01.shk.0000191414.94461.7e |
| [5] | 陈怀宇, 林名瑞, 何绍吾, 等. 犀角地黄汤对脓毒症大鼠脾脏组织基因表达的影响[J]. 蛇志, 2018, 30(1): 4-6, 12. DOI:10.3969/j.issn.1001-5639.2018.01.002 |
| [6] | Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority:A WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/nejmp1707170 |
| [7] | Venet F, Monneret G. Advances in the understanding and treatment of sepsis-induced immunosuppression[J]. Nat Rev Nephrol, 2018, 14(2): 121-137. DOI:10.1038/nrneph.2017.165 |
| [8] | Sweeney TE, Perumal TM, Henao R, et al. A community approach to mortality prediction in sepsis via gene expression analysis[J]. Nat Commun, 2018, 9(1): 694. DOI:10.1038/s41467-018-03078-2 |
| [9] | Cesta MF. Normal structure, function, and histology of the spleen[J]. Toxicol Pathol, 2006, 34(5): 455-465. DOI:10.1080/01926230600867743 |
| [10] | Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in sepsis[J]. Nat Rev Nephrol, 2018, 14(7): 417-427. DOI:10.1038/s41581-018-0005-7 |
| [11] | 林名瑞, 林建东, 肖雄箭. 脓毒症大鼠脾组织基因表达变化[J]. 中华急诊医学杂志, 2013, 22(3): 266-271. DOI:10.3760/cma.j.issn.1671-0282.2013.03.009 |
| [12] | 张卉, 冯永文, 姚咏明. 自噬在脓毒症免疫反应中的潜在作用与意义[J]. 中华急诊医学杂志, 2019, 28(2): 131-134. DOI:10.3760/cma.j.issn.1671-0282.2019.02.001 |
| [13] | 陈隆望, 邱俏檬, 连洁, 等. microRNA-10a对脓毒症小鼠脾脏CD4+CD25+Treg免疫功能的影响[J]. 中华急诊医学杂志, 2018, 27(2): 152-158. DOI:10.3760/cma.j.issn.1671-0282.2018.02.009 |
| [14] | Kumar V. T cells and their immunometabolism:A novel way to understanding sepsis immunopathogenesis and future therapeutics[J]. Eur J Cell Biol, 2018, 97(6): 379-392. DOI:10.1016/j.ejcb.2018.05.001 |
| [15] | 姜洁, 吕菁君, 魏捷. 细胞焦亡途径以及细胞焦亡对脓毒症免疫反应的潜在影响[J]. 中华急诊医学杂志, 2019, 28(5): 655-658. DOI:10.3760/cma.j.issn.1671-0282.2019.05.029 |
 2020, Vol. 29
2020, Vol. 29




