肺是脓毒症发生发展过程中最早且最容易受损的靶器官,急性肺损伤(acute lung injury, ALI)是脓毒症多器官功能损害在肺部的表现。自噬(autophagy)是一个高度保守的、细胞内蛋白质或细胞器降解的过程,是维持机体内环境稳态的一种重要途径,研究表明,自噬参与了脓毒症的发生和发展[1]。目前普遍认为自噬对细胞稳态和存活至关重要,自噬途径代表了一种主要的适应性反应, 以维持细胞和组织的动态平衡,以应对多种细胞应激[2]。目前很多学者已经观察到多种肺部疾病中存在自噬活性的变化,越来越多的研究表明自噬与ALI之间存在密切关系[3],主要表现为自噬参与了ALI的内源性保护机制[4]。Th17细胞和Treg细胞是ALI免疫紊乱发生与发展的重要调节细胞,自噬是否会影响Th17细胞和Treg细胞在ALI中的免疫紊乱过程,目前尚无系统研究报告,而这对研究自噬在ALI的发病机制及免疫紊乱反应有着重要的理论价值和临床意义。本研究以ALI小鼠模型为基础,评估自噬对ALI小鼠肺组织中Treg细胞和Th17细胞失衡的影响,为进一步研究自噬在ALI中的作用机制及临床应用提供新的理论依据。
1 材料与方法 1.1 实验动物SPF级C57BL/6小鼠54只,雄性,6~8周龄,体重18~22 g,由武汉大学同仁医院(武汉市第三医院)动物实验中心提供。动物实验伦理委员会批准号为武三医实伦SY2019-030。
1.2 主要试剂和仪器脂多糖内毒素(lipopolysaccharide, LPS)购自Sigma-Aldrich公司,白介素(interleukin, IL)-6、IL-10、IL-17、IL-23、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、TGF-β1、高迁移率族蛋白1(high mobility group protein 1, HMGBl)及单核细胞趋化蛋白-l(monocyte chemoattractant protein-1, MCP-1)ELISA试剂盒均购自武汉华美生物工程有限公司,3-甲基腺嘌呤购自美国Bio Vision公司。
1.3 LPS-ALI模型制备ALI模型依据文献[5],采用LPS气管滴注法制备ALI模型。小鼠称重,各组小鼠均腹腔注射3%戊巴比妥钠(45 mg/kg)麻醉,仰卧固定于实验台,颈部皮肤消毒,切开皮肤,逐层分离皮下组织,暴露气管。挑起气管, 除对照组外,其余各组小鼠气管内缓慢滴入2% LPS(2 mg/kg,30 μL),对照组滴入等量生理盐水。右颈动脉插管连接监护仪行持续动脉压监测。手术完毕后缝合手术切口,迅速将动物直立、旋转,使药液在肺内分布均匀。动物清醒后常规饲养。小鼠LPS-ALI模型复制成功标准:HE染色可见肺间质充血、水肿,肺泡间隔明显增宽,肺间质和肺泡腔内有大量炎症细胞浸润、出血,大量肺泡萎陷;动脉血气分析PaO2/FiO2≤300 mmHg(1 mmHg=0.133 kPa)。
1.4 实验分组及实验方法采用随机数字表法分为3组(n=54只):假手术组(S组)、脓毒症组(Sep组)和自噬抑制剂3-甲基腺嘌呤组(Sep+3-MA组),每组18只。3-MA组于术后1 h腹腔注射3-MA 15mg/kg。分别于6 h、12 h、24 h和48 h取2只小鼠,进行支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞计数,同时留取肺组织待检。观察7 d生存情况:每组随机取10只小鼠,观察术后7 d生存情况,计算7 d生存率。
1.5 肺组织湿重∕干重比值(W/D比值)测定小鼠处死后,取左肺下叶组织,称湿重后,将其置于80℃微波炉中烘48 h,然后取出称干重,计算W/D比值。肺损伤程度评分:取右肺组织4%多聚甲醛固定,脱钙剂脱钙72 h,逐级乙醇脱水,二甲苯透明、浸蜡,石蜡包埋,切成4 mm的薄片,苏木精-伊红(HE)染色。在光学显微镜下观察肺组织病理形态学改变。每个标本观察5个视野。病理评分基于肺泡和间质水肿、炎症细胞浸润、出血。严重程度评分:无损伤计1分,损伤25%计2分,损伤50%计3分,损伤75%计4分,弥漫性损伤计5分。
1.6 BALF中Th17细胞和Treg细胞计数分别于6 h、12 h、24 h和48 h取2只小鼠,麻醉后置于清洁的实验台上,打开胸腔,暴露肺和气管,气管切幵后插入软管并固定。通过软管注射PBS(pH值7.4)0.3 mL,静置30 s后回抽,共进行3次注射与回抽。将收集到的BALF 4℃ 1500 r/min离心10 min,离心半径10 cm,取上清液-20℃保存。BALF中细胞用PBS重悬,采用流式细胞仪计数Th17细胞和Treg细胞。采用直接计数法,以CD4PE(美国Cahag公司)设门,经CD25 FITC(美国Caltag公司)染色30 min。流式细胞仪(美国Beckman Coulter公司,Epics-XL4)计数,全部数据经EXP032 ADC软件获取分析。ELISA检测气管BALF中IL-17、IL-10、TNF-a及TGF-β1水平:将BALF分离,取上清液,采用ELISA试剂盒(奥地利Bender Med Systems公司),按试剂说明书操作,使用BioTek全自动荧光酶标免疫测定仪进行检测IL-17、IL-10、TNF-a及TGF-β1水平。在操作前注意试剂盒冰箱取出后放置约20 min,以平衡至室温。
1.7 BALF中Th17细胞和Treg细胞内自噬蛋白微管相关蛋白1轻链3Ⅱ型(LC3Ⅱ)、Beclin-1及p62的表达采用Western blot法测定BALF中Th17细胞和Treg细胞内自噬蛋白LC3Ⅱ、Beclin-1及p62的表达:取BALF,加入细胞裂解液后匀浆、离心,取上清液测蛋白浓度。经SDS凝胶电泳,转至PVDF膜(美国Millipore公司)。5%脱脂奶粉室温封闭2 h,洗膜后分别加入一抗LC3Ⅱ/(稀释度1∶100,美国Novus Biologicals公司)、Beclin-1(稀释度l∶500,美国BD Biosciences公司)、Rab7(稀释度1∶1 000,美国Novus Biologicals公司)和LAMP2(稀释度1∶500,英国Abcam公司),4℃孵育过夜;加入相应二抗,室温孵育1 h,暗室内显色,曝光,扫描。采用Gene Tools图像分析系统进行分析,以目的蛋白条带灰度值与β-actin条带灰度值的比值反映目的蛋白的表达水平。
1.8 统计学方法统计使用SPSS 22.0软件处理,正态分布计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 7d生存情况S组7 d生存率为100%,Sep组7 d生存率为0%,Sep+3-MA组7 d生存率为30%。与S组比较,Sep组7 d生存率降低(P < 0.05);与Sep组比较,Sep+3-MA组7 d生存率升高(P < 0.05)。
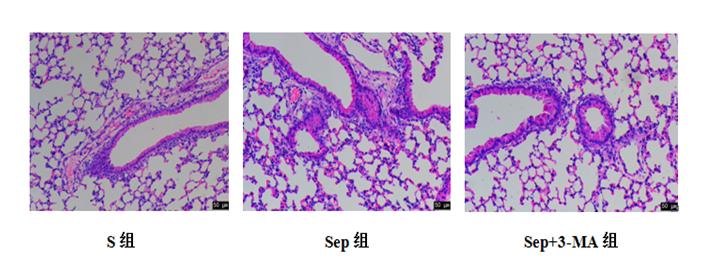
2.2 各组小鼠肺组织病理学损伤评分及W/D比值光镜下,S组肺泡结构未见明显异常,Sep组肺组织结构严重破坏,肺泡、肺间质充血明显,肺泡间隔明显增宽,肺泡腔内见大量中性粒细胞浸润及少量纤维蛋白渗出;Sep+3-MA组肺组织病理学损伤明显加重。与S组比较,Sep组和Sep+3-MA组肺组织病理学评分、W/D比值升高(P < 0.05);与Sep组比较,Sep+3-MA组肺组织病理学评分、W/D比值升高,见表 1、图 1。
| 组别 | 6 h | 12 h | 24 h | 48 h |
| W/D(%) | ||||
| S组 | 0.53±0.02 | 0.50±0.03 | 0.49±0.02 | 0.48±0.03 |
| Sep组 | 0.66±0.05a | 0.69±0.04a | 0.63±0.03a | 0.62±0.04a |
| Sep+3-MA组 | 0.72±0.02ab | 0.85±0.04ab | 0.75±0.02ab | 0.67±0.03ab |
| 肺损伤评分 | ||||
| S组 | 0.66±0.20 | 0.63±0.21 | 0.62±0.19 | 0.60±0.20 |
| Sep组 | 5.28±0.25a | 5.49±0.23a | 5.23±0.22a | 5.16±0.20a |
| Sep+3-MA组 | 6.33±0.18ab | 7.51±0.24ab | 6.64±0.21ab | 5.97±0.15ab |
| 注:与S组比较,aP < 0.05;与Sep组比较,bP < 0.05 | ||||
|
| 图 1 各组小鼠12 h肺组织比较(HE×200 Fig 1 Comparison of 12 h lung tissue status of mice in each group (HE, original magnification×200) |
|
|
与S组比较,Sep组Th17细胞计数升高,Treg细胞计数在脓毒症的早期下降,而随着脓毒症的发展,Treg细胞计数升高P < 0.05);与Sep组比较,Sep+3-MA组Th17细胞计数下降,Treg细胞计数随着脓毒症的发展明显升高(P < 0.05)。与S组比较,Sep组IL-17、IL-10和TNF-α的水平均明显升高(P < 0.05);而TGF-β1的水平在脓毒症的早期下降,而随着脓毒症的发展,TGF-β1的水平升高(P < 0.05);与Sep组比较,Sep+3-MA组IL-17、IL-10和TNF-α的水平均明显下降(P < 0.05);而TGF-β1的水平在脓毒症的早期升高,而随着脓毒症的发展,TGF-β1的水平明显下降(P < 0.05)。见表 2。
| 组别 | 6 h | 12 h | 24 h | 48 h |
| Th17细胞(%) | ||||
| S组 | 1.12±0.07 | 1.21±0.09 | 1.18±0.06 | 1.16±0.05 |
| Sep组 | 3.67±0.22a | 4.21±0.25a | 4.16±0.27a | 3.99±0.26a |
| Sep+3-MA组 | 2.53±0.14b | 3.34±0.10b | 3.19±0.15b | 3.04±0.13b |
| Treg细胞(%) | ||||
| S组 | 6.47±0.52 | 6.32±0.10 | 6.49±0.43 | 6.51±0.64 |
| Sep组 | 4.60±0.83a | 4.47±0.71a | 9.28±1.24a | 12.67±1.76a |
| Sep+3-MA组 | 3.60±0.27a | 3.13±0.25b | 6.45±0.84b | 8.17±1.06b |
| IL-17(pg/mL) | ||||
| S组 | 7.49±0.76 | 7.41±0.72 | 7.56±0.83 | 7.58±0.77 |
| Sep组 | 62.47±5.78a | 74.83±5.47a | 69.43±6.03a | 60.71±4.99a |
| Sep+3-MA组 | 43.73±3.85b | 57.35±3.76b | 51.85±3.63b | 48.41±3.19b |
| IL-10(pg/mL) | ||||
| S组 | 2.36±0.32 | 2.53±0.27 | 2.85±0.28 | 2.96±0.31 |
| Sep组 | 32.32±4.55a | 25.86±4.37a | 36.53±4.84a | 42.76±4.37a |
| Sep+3-MA组 | 23.67±3.13b | 20.28±3.52b | 27.67±3.46b | 30.73±3.06b |
| TNF-α(pg/mL) | ||||
| S组 | 53.64±4.49 | 55.62±4.72 | 52.35±4.27 | 51.31±4.37 |
| Sep组 | 531.37±47.23a | 476.44±34.19a | 379.18±31.83a | 325.62±27.52a |
| Sep+3-MA组 | 863.27±87.56b | 724.36±71.62b | 563.27±57.81b | 487.34±41.38b |
| TGF-β1(pg/mL) | ||||
| S组 | 42.36±3.67 | 41.67±3.21 | 44.14±3.37 | 45.64±3.11 |
| Sep组 | 28.67±2.87a | 25.39±2.20a | 56.24±4.88a | 67.49±5.48a |
| Sep+3-MA组 | 39.13±3.32b | 35.37±3.01b | 52.29±4.63 | 60.39±5.13b |
| 注:与S组比较,aP < 0.05;与Sep组比较,bP < 0.05 | ||||
与S组比较,Sep组小鼠BALF中Th17细胞和Treg细胞内LC3Ⅱ和Beclin-1的表达明显升高(P < 0.05),p62的表达明显下降。与Sep组比较,Sep+3-MA组小鼠BALF中Th17细胞和Treg细胞内LC3Ⅱ的表达呈下降趋势,但差异无统计学意义,Beclin-1表达则明显下降(P < 0.05),而p62的表达明显升高(P < 0.05),见表 3、图 2和图 3。
| 组别 | 6 h | 12 h | 24 h | 48 h |
| Th17细胞内 | ||||
| LC3Ⅱ | ||||
| S组 | 0.93±0.05 | 0.95±0.06 | 0.94±0.04 | 0.91±0.06 |
| Sep组 | 1.36±0.17a | 1.64±0.21a | 1.58±0.19a | 1.55±0.16a |
| Sep+3-MA组 | 1.32±0.14 | 1.47±0.13 | 1.45±0.16 | 1.44±0.14 |
| Beclin-1 | ||||
| S组 | 1.03±0.07 | 1.07±0.08 | 0.98±0.7 | 0.97±0.05 |
| Sep组 | 1.53±0.15a | 1.62±0.19a | 1.59±0.20a | 1.57±0.16a |
| Sep+3-MA组 | 0.94±0.06b | 0.99±0.05b | 0.91±0.04b | 0.87±0.04b |
| p62 | ||||
| S组 | 0.52±0.06 | 0.56±0.07 | 0.50±0.05 | 0.48±0.04 |
| Sep组 | 0.43±0.04a | 0.46±0.05a | 0.39±0.03a | 0.36±0.03a |
| Sep+3-MA组 | 0.56±0.05b | 0.58±0.05b | 0.52±0.04b | 0.50±0.03b |
| Treg细胞内 | ||||
| LC3Ⅱ | ||||
| S组 | 0.53±0.05 | 0.55±0.06 | 0.54±0.04 | 0.51±0.03 |
| Sep组 | 0.82±0.08a | 0.88±0.09a | 0.85±0.07a | 0.83±0.06a |
| Sep+3-MA组 | 0.81±0.07 | 0.85±0.06 | 0.83±0.05 | 0.81±0.03 |
| Beclin-1 | ||||
| S组 | 0.73±0.05 | 0.77±0.07 | 0.72±0.05 | 0.70±0.05 |
| Sep组 | 1.13±0.09a | 1.22±0.14a | 1.19±0.12a | 1.17±0.10a |
| Sep+3-MA组 | 0.56±0.07b | 0.61±0.07b | 0.58±0.06b | 0.54±0.06b |
| p62 | ||||
| S组 | 1.02±0.08 | 1.06±0.08 | 0.97±0.07 | 0.93±0.07 |
| Sep组 | 0.93±0.08a | 0.99±0.11a | 0.95±0.07a | 0.92±0.06a |
| Sep+3-MA组 | 1.36±0.13b | 1.42±0.14b | 1.32±0.14b | 1.27±0.11b |
| 注:与S组比较,aP < 0.05;与Sep组比较,bP < 0.05 | ||||

|
| 图 2 Th17细胞内LC3Ⅱ、Beclin-1和P62的表达(12 h) Fig 2 Expression of LC3Ⅱ, Beclin-1 and P62 in Th17 cells (12 h) |
|
|

|
| 图 3 Treg细胞内LC3Ⅱ、Beclin-1和P62的表达(12 h) Fig 3 Expression of LC3Ⅱ, Beclin-1 and P62 in Treg cells (12 h) |
|
|
脓毒症是临床常见的危重症,而肺脏是脓毒症时易受损的靶器官之一,脓毒症导致的ALI或急性呼吸窘迫综合征是进展为多脏器衰竭的危险因素。严重脓毒症患者中有25%~50%并发ALI,而脓毒症所致的ALI病死率高达70%~90%。Th17细胞和Treg细胞是CD4+T淋巴细胞亚群,它们在维持机体免疫平衡过程中发挥重要作用,免疫相关性疾病和感染性疾病中均广泛存在Thl7/Treg细胞平衡失调。从目前对脓毒症研究的来看,Th17细胞的增高与患者的强烈的炎症反应状态有关[6],而Treg细胞的表达明显增加将导致患者免疫麻痹[7];而笔者前期对脓毒症大鼠的研究也表明,Th17细胞和Treg细胞参与了脓毒症免疫紊乱的过程[8-9]。目前研究表明多种肺部疾病中存在自噬活性的变化,自噬与ALI之间存在密切关系,主要表现为自噬参与了ALI的内源性保护机制[10]。自噬对脓毒症ALI免疫紊乱有着非常重要的影响,但其是否能通过影响Th17细胞和Treg细胞的失衡来影响脓毒症ALI的免疫紊乱过程,尚需进一步研究。
近年来,自噬被认为是维持T细胞稳态的重要环节,在T细胞介导的自身免疫性疾病中发挥着重要的作用。Beclin-1是哺乳动物参与自噬的特异性基因,可参与自噬体的形成,调控、促进自噬体的成熟,与自噬体的数量关系密切[11]。LC3-Ⅱ和p62是监测自噬流的关键性标志[12-13]。LC3-Ⅱ水平的增加表明自噬泡的形成,提示其合成增加或降解减少。p62是一个泛素结合的自噬受体和信号蛋白,它的聚积提示自噬-溶酶体通路障碍[14]。本研究采用LPS气管滴注法制备ALI模型,通过3-甲基腺嘌呤处理后,在光镜下评估小鼠肺组织病理学损伤评分并计算W/D比值,通过流式细胞术检测小鼠BALF中Th17细胞和Treg细胞计数及其相关细胞因子的水平,Western blot法测定BALF中Th17细胞和Treg细胞内LC3-Ⅱ、Beclin-1和p62的表达。本研究发现经过3-MA处理后,ALI小鼠肺部损伤情况早期明显加重,但随着脓毒症的发展,ALI小鼠肺部损伤情况减轻。BALF中Th17和Treg细胞中的LC3Ⅱ的表达呈下降趋势,但差异无统计学意义,Beclin-1表达则明显下降,而p62的表达明显升高,提示其胞内自噬被有效抑制。而有趣的是,3-MA处理后BALF中的Th17细胞比例下降,Treg细胞比例升高,且经ELISA检测,发现BALF中IL-17水平降低,TGF-β1水平升高,此结果表明,自噬对不同T细胞亚群产生的影响是不一致的。可能的解释为,自噬抑制剂会阻断Treg中关键转录因子Foxp3的降解,从而影响Treg细胞的分化及功能,通过自噬抑制剂抑制自噬可以重新恢复Th17/Treg免疫失衡。
目前,脓毒症淋巴细胞自噬多处于基础研究阶段,自噬如何从保护淋巴细胞转变为促进其凋亡未能阐述清楚,今后仍需要大量的基础和临床实验加以验证。在本项研究中,证实了异常激活的自噬参与了脓毒症ALI中Th17/Treg细胞的失衡,抑制自噬可恢复Th17细胞和Treg细胞的功能,使被打破了的平衡得到改善,通过抑制自噬改善Th17/Treg失衡可能成为调控脓毒症免疫紊乱的新思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王华兵:研究设计、实验操作、论文撰写;董芳:研究设计、论文修改;徐玲文:实验操作;揭凤英:统计学分析
| [1] | Abu El-Asrar AM, Alam K, Garcia-Ramirez M, et al. Association of HMGB1 with oxidative stress markers and regulators in PDR[J]. Mol Vis, 2017, 23: 853-871. |
| [2] | Wang K, Chen Y, Zhang PJ, et al. Protective features of autophagy in pulmonary infection and inflammatory diseases[J]. Cells, 2019, 8(2): E123. DOI:10.3390/cells8020123 |
| [3] | Choi AM, Ryter SW, Levine B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368(19): 1845-1846. DOI:10.1056/NEJMc1303158 |
| [4] | 董艾莉, 陈红光, 谢克亮, 等. 自噬在脓毒症小鼠肺损伤中的作用[J]. 中华麻醉学杂志, 2015, 35(9): 1124-1127. DOI:10.3760/cma.j.issn.0254-1416.2015.09.026 |
| [5] | 付静怡, 汪雷, 杨异. 急性肺损伤动物模型建立的研究进展[J]. 上海交通大学学报(医学版), 2021, 41(5): 690-694. DOI:10.3969/j.issn.1674-8115.2021.05.022 |
| [6] | 亢翠翠, 吴铁军, 张保军. 脓毒症患者外周血中Thl7细胞检测及意义[J]. 中华急诊医学杂志, 2012, 21(4): 378-380. DOI:10.3760/cma.j.issn.1671-0282.2012.04.011 |
| [7] | Wu JI, Wang LH. Emerging roles of gap junction proteins connexins in cancer metastasis, chemoresistance and clinical application[J]. J Biomed Sci, 2019, 26(1): 8. DOI:10.1186/s12929-019-0497-x |
| [8] | 王华兵, 董芳, 徐玲文. 脓毒症大鼠肠损伤时Treg细胞/Th17细胞的变化[J]. 中华麻醉学杂志, 2020, 40(3): 366-368. DOI:10.3760/cma.j.cn131073.20190220.00327 |
| [9] | 王华兵, 董芳, 徐玲文. 胸腺肽α1对大鼠脓毒症的影响[J]. 中华麻醉学杂志, 2019, 39(7): 877-880. DOI:10.3760/cma.j.issn.0254-1416.2019.07.028 |
| [10] | Siempos Ⅱ, Lam HC, Ding Y, et al. Cecal ligation and puncture-induced Sepsis as a model to study autophagy in mice[J]. J Vis Exp, 2014(84): e51066. DOI:10.3791/51066 |
| [11] | Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation[J]. Nature, 2011, 469(7330): 323-335. DOI:10.1038/nature09782 |
| [12] | Kim EM, Bae YM, Choi MH, et al. Connexin 43 plays an important role in the transformation of cholangiocytes with Clonochis sinensis excretory-secretory protein and N-nitrosodimethylamine[J]. PLoS Negl Trop Dis, 2019, 13(4): e0006843. DOI:10.1371/journal.pntd.0006843 |
| [13] | Fan WL, Liu P, Wang G, et al. Transplantation of hypoxic preconditioned neural stem cells benefits functional recovery via enhancing neurotrophic secretion after spinal cord injury in rats[J]. J Cell Biochem, 2018, 119(6): 4339-4351. DOI:10.1002/jcb.26397 |
| [14] | Wakai T, Narasimhan P, Sakata H, et al. Hypoxic preconditioning enhances neural stem cell transplantation therapy after intracerebral hemorrhage in mice[J]. J Cereb Blood Flow Metab, 2016, 36(12): 2134-2145. DOI:10.1177/0271678x15613798 |
 2022, Vol. 31
2022, Vol. 31




