静脉-动脉体外膜肺氧合(venous-arterial extracorporeal membrane oxygenation,VA-ECMO)作为一种体外生命支持方式,可以为心肺功能衰竭的危重患者的抢救以及原发病的治疗创造时机[1]。急性生理和慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHEⅡ)作为一种危重症评分系统,目前已广泛应用于重症监护病房,是评估患者疾病严重程度及其预后的良好指标。血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、单核细胞/淋巴细胞比值(lymphocyte-to-monocyte ratio,LMR)是近年来提出的能快速反应机体免疫炎症状态的指标,通过血常规计算即可获取,相较于血细胞单一指标与肺栓塞[2]、脓毒症[3]、癌症[4]的预后预测具有更好的相关性,然而目前关于早期外周血炎症指标在VA-ECMO患者中的临床预后评估的报道甚少。
ECMO建立成本较高,并且建立后常伴随着体外循环的炎症反应[5]如果不加以控制,可能会导致炎症和器官损伤,患者死亡风险增加。因此,积极探索VA-ECMO患者预后早期炎症指标具有重要的临床应用价值。本研究回顾性分析VA-ECMO患者资料,首次在VA-ECMO患者中探讨辅助前APACHEⅡ评分联合早期全血细胞亚型比值的预后预测价值。
1 资料与方法 1.1 一般资料回顾性分析2017年1月至2020年6月南京医科大学第一附属医院(江苏省人民医院)急诊科收治的VA-ECMO成人患者共109例。ECMO治疗时间 < 3 d(18例)、年龄 < 18岁(2例)或 > 80岁(0例)患者被排除,最终共89例患者被纳入研究。收集患者的一般资料、生命体征、实验室指标及其他数据等。本研究的伦理审批号为2020-SR-226,已获得患者知情同意。
1.2 ECMO治疗本中心VA-ECMO的具体适应证主要包括难治性院内或院外心脏骤停、由于严重的心肌病、心肌炎、急性冠脉综合征、药物过量或脓毒症等各种原因引起的心力衰竭或心源性休克[6-8]。VA-ECMO的环路组成、建立、撤机以及患者临床管理详见本中心前期经验[9]。
1.3 PLR、NLR、LMR及患者数据记录患者数据均采集自本中心病历管理系统。连续记录PLR、NLR、LMR四个时间点数值,分别为:ECMO辅助前最后一次、ECMO辅助后24 h、48 h和72 h。APACHEⅡ评分记录时间点为:ECMO辅助前。记录ECMO辅助后28 d生存情况作为结局指标,并分组为生存组和死亡组。
1.4 统计学方法应用SPSS 24.0统计软件进行数据处理,服从或近似服从正态分布的连续数值资料采用均数±标准差(x±s)表示,组间比较采用t检验。偏态分布计量资料以中位数(四分位间距)[M(Q1,Q3)],组间比较采用秩和检验。计数资料以百分比表示,组间比较采用χ2检验或Fisher确切概率法。以二元Logistic回归分析VA-ECMO患者28 d死亡相关影响因素,采用受试者工作特征曲线(ROC)分析最佳截断值,比较高风险组和低风险组间ECMO相关并发症的差异,以P < 0.05为差异有统计学意义。
2 结果 2.1 比较存活组和死亡组间基线资料存活组和死亡组患者在年龄、性别、体重、既往史[包括高血压、冠心病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、脑梗塞、肿瘤、吸烟史、饮酒史]、接受ECMO治疗原因[包括心搏骤停61例、急性心肌梗死6例、重症心肌炎17例、其他(新型布尼亚病毒、重症肺炎、肾综合征出血热、甲状腺功能亢进症、支气管哮喘急性发作各1例)]、上机前实验室指标(白细胞、淋巴细胞、单核细胞、中性粒细胞、血小板、血红蛋白、红细胞、降钙素原)均差异无统计学意义(P > 0.05),见表 1。
| 指标 | 生存组(n=50) | 死亡组(n=39) | P值 |
| 年龄(岁)a | 44.0(30.5, 56.0) | 46.0(30.0, 62.0) | 0.280 |
| 性别(例,%) | 0.155 | ||
| 男 | 30(60.0) | 29(74.4) | |
| 女 | 20(40.0) | 10(25.6) | |
| 体重(kg)b | 65.6±12.4 | 68.9±11.7 | 0.166 |
| 既往史、个人史(例,%) | |||
| 高血压 | 10(20.0) | 11(28.2) | 0.366 |
| 糖尿病 | 5(10.0) | 10(25.6) | 0.050 |
| 冠心病 | 7(17.9) | 3(6.0) | 0.077 |
| COPD | 1(2.0) | 1(2.6) | 0.859 |
| 脑梗塞 | 2(4.0) | 0(0) | 0.206 |
| 肿瘤 | 3(6.0) | 2(5.1) | 0.859 |
| 吸烟 | 15(30.0) | 16(41.0) | 0.279 |
| 饮酒 | 8(16.0) | 6(15.4) | 0.937 |
| 接受ECMO治疗原因(例,%) | |||
| 心搏骤停 | 34(68.0) | 27(69.2) | 0.901 |
| 急性心肌梗死 | 2(4.0) | 4(10.3) | 0.243 |
| 重症心肌炎 | 12(24.0) | 5(12.8) | 0.183 |
| 其他 | 2(4.0) | 3(7.7) | 0.453 |
| 辅助前指标 | |||
| APACHEⅡa | 20.0(16.5, 33.0) | 33.0(26.0, 37.0) | 0.001 |
| 白细胞(×109/L)a | 13.2(9.01, 22.5) | 16.1(11.4, 20.6) | 0.226 |
| 淋巴细胞(×109/L)a | 1.1(0.7, 1.5) | 1.3(0.8, 2.5) | 0.325 |
| 单核细胞(×109/L)a | 0.7(0.4, 1.3) | 0.7(0.5, 0.9) | 0.788 |
| 中性粒细胞(×109/L)a | 11.3(6.9, 20.3) | 14.6(9.2, 18.5) | 0.252 |
| 血小板(×109/L)b | 178.8±71.4 | 160.9±85.4 | 0.147 |
| 血红蛋白(×109/L)b | 125.1±22.8 | 123.7±26.7 | 0.727 |
| 红细胞(×1012/L)b | 4.2±0.8 | 4.0±0.8 | 0.356 |
| 降钙素原(ng/mL)a | 1.0(0.4, 6.3) | 4.1(0.2, 19.1) | 0.220 |
| 注:COPD为慢性阻塞性肺疾病,ECMO为体外膜肺氧合,APACHEⅡ评分为急性生理学及慢性健康状况评分;a为M(Q1,Q3),b为x±s | |||
两组患者在辅助前APACHEⅡ评分、ECMO的PLR和LMR分布(辅助前、辅助后24 h、48 h、72 h)、辅助前NLR间差异有统计学意义(P < 0.05),见表 1、2。
| 指标 | 生存组(n=50) | 死亡组(n=39) | P值 |
| ECMO的PLR分布 | |||
| 辅助前 | 173.5(108.4, 263.0) | 94.7(33.5, 170.3) | 0.001 |
| 辅助后24 h | 151.5(108.2, 211.5) | 89.3(52.6, 153.8) | 0.001 |
| 辅助后48 h | 161.8(93.4, 218.3) | 67.0(41.8, 125.4) | < 0.001 |
| 辅助后72 h | 125.7(90.1, 202.8) | 77.8(44.7, 131.4) | 0.001 |
| ECMO的NLR分布 | |||
| 辅助前 | 14.3(7.0, 20.8) | 8.5(4.0, 14.9) | 0.028 |
| 辅助后24 h | 13.7(9.4, 19.2) | 12.2(7.7, 16.7) | 0.162 |
| 辅助后48 h | 14.4(9.0, 20.4) | 12.6(9.6, 18.6) | 0.600 |
| 辅助后72 h | 14.1(8.7, 20.1) | 13.1(8.5, 23.4) | 0.856 |
| ECMO的LMR分布 | |||
| 辅助前 | 1.2(0.8, 3.2) | 2.5(1.3, 5.1) | 0.002 |
| 辅助后24 h | 1.2(1.0, 1.7) | 1.9(1.3, 3.3) | 0.001 |
| 辅助后48 h | 1.2(0.7, 1.6) | 1.7(1.1, 2.4) | 0.010 |
| 辅助后72 h | 1.1(0.8, 1.6) | 1.6(1.0, 2.5) | 0.013 |
| 注:ECMO为体外膜肺氧合,PLR为血小板/淋巴细胞比值,NLR为中性粒细胞/淋巴细胞比值,LMR为单核细胞/淋巴细胞比值 | |||
将上述单因素分析存在差异的变量纳入二元logistic回归分析,结果见表 3。PLR(ECMO后48 h)(OR=1.013,95%CI: 1.001~1.025,P=0.033)、LMR(ECMO后24 h)(OR=0.436,95%CI: 0.224~0.849,P=0.015)、LMR(ECMO后72 h)(OR=1.570,95%CI: 1.087~2.267,P=0.016)、APACHEⅡ(OR=0.933,95%CI: 0.872~0.998,P=0.044)为VA-ECMO患者辅助后28 d死亡的独立危险因素(表 3)。
| 变量 | OR | 95%CI | P值 |
| PLR(辅助前) | 1.001 | 0.993~1.009 | 0.767 |
| PLR(ECMO后24 h) | 0.993 | 0.984~1.002 | 0.144 |
| PLR(ECMO后48 h) | 1.013 | 1.001~1.025 | 0.033 |
| PLR(ECMO后72 h) | 1.003 | 0.993~1.014 | 0.546 |
| NLR(辅助前) | 1.043 | 0.953~1.143 | 0.358 |
| LMR(辅助前) | 1.031 | 0.852~1.246 | 0.756 |
| LMR(ECMO后24 h) | 0.436 | 0.224~0.849 | 0.015 |
| LMR(ECMO后48 h) | 0.849 | 0.570~1.264 | 0.419 |
| LMR(ECMO后72 h) | 1.570 | 1.087~2.267 | 0.016 |
| APACHE Ⅱ | 0.933 | 0.872~0.998 | 0.044 |
| 注:ECMO为体外膜肺氧合,PLR为血小板/淋巴细胞比值,NLR为中性粒细胞/淋巴细胞比值,LMR为单核细胞/淋巴细胞比值,APACHEⅡ评分为急性生理学及慢性健康状况评分 | |||
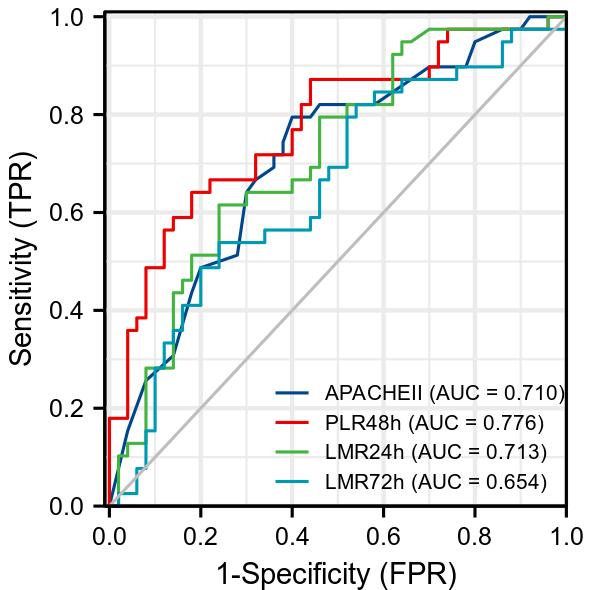
ROC曲线分析显示约登指数最大的截断值分别为APACHEⅡ 25.5、PLR 48 h 84.624、LMR 24 h 1.714、LMR 72 h 1.592,AUC曲线下面积依次为PLR 48 h > LMR 24 h > APACHEⅡ > LMR 72 h,其中PLR 48 h组敏感度达到0.820,特异度达到0.735(表 4,图 1)。
| 因素 | AUC | 截断值 | 敏感度 | 特异度 | 约登指数 |
| APACHEⅡ | 0.710 | 25.500 | 0.795 | 0.600 | 0.395 |
| PLR 48 h | 0.776 | 84.624 | 0.820 | 0.735 | 0.461 |
| LMR 24 h | 0.713 | 1.714 | 0.760 | 0.667 | 0.375 |
| LMR 72 h | 0.654 | 1.592 | 0.760 | 0.636 | 0.298 |
| 注:APACHEⅡ评分为急性生理学及慢性健康状况评分,PLR为血小板/淋巴细胞比值,NLR为中性粒细胞/淋巴细胞比值,LMR为单核细胞/淋巴细胞比值 | |||||
|
| 图 1 APACHEⅡ及PLR、LMR对ECMO患者生存预后的ROC曲线 Fig 1 ROC curves of APACHEⅡ, PLR, and LMR on prognosis of ECMO patients |
|
|
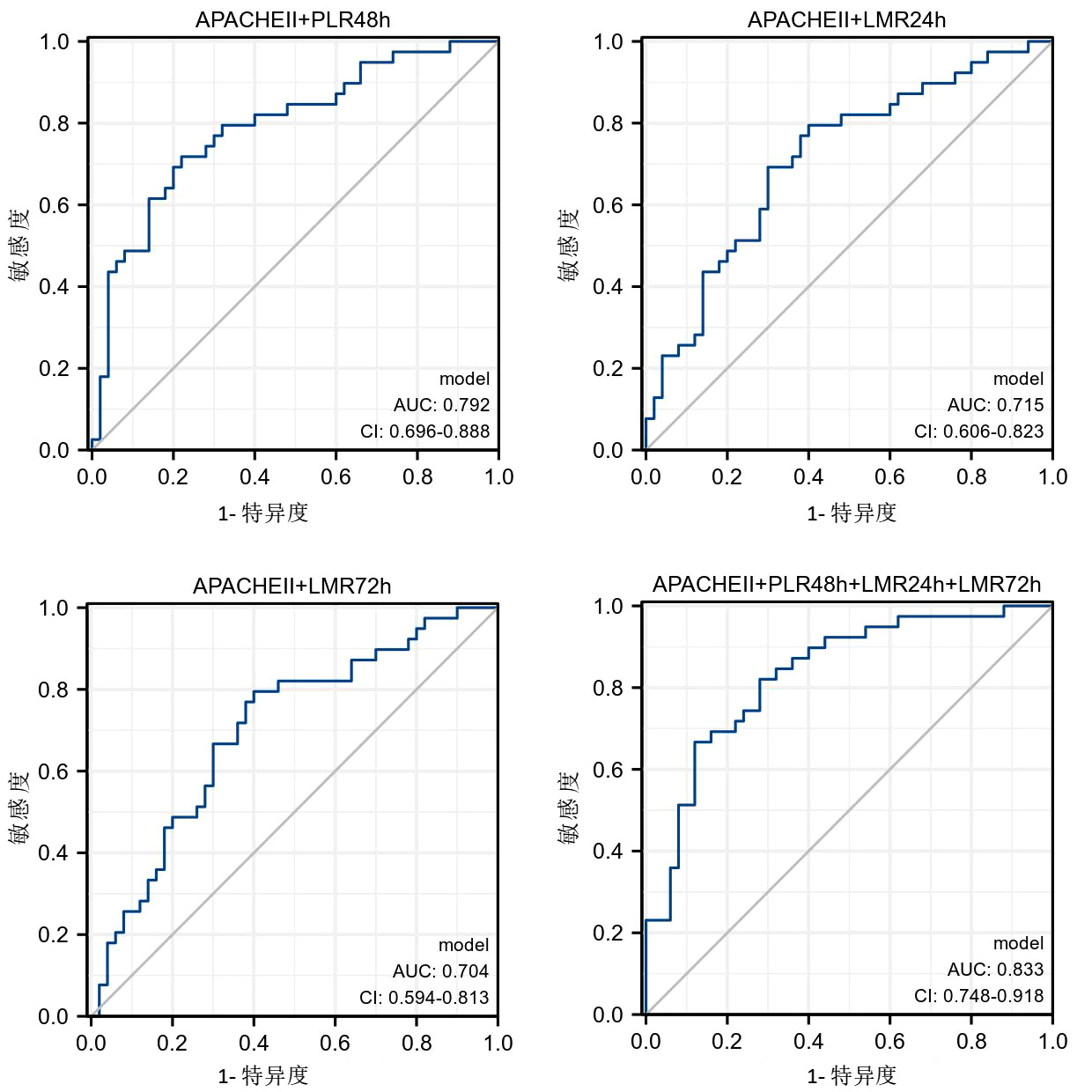
以APACHEⅡ为基础,与其他几个比值变量进行联合ROC分析,结果显示,APACHEⅡ+PLR 48 h、APACHEⅡ+LMR 24 h、APACHEⅡ+LMR 72 h、APACHEⅡ+PLR 48h+LMR 24h+LMR 72 h四种不同组合对VA-ECMO患者生存预后诊断的AUC分别为0.792、0.715、0.704、0.833,其中,APACHEⅡ+LMR 24 h和APACHEⅡ+LMR 72 h两组的敏感度均达到0.795,APACHEⅡ+PLR 48 h+LMR 24 h+LMR 72 h组的特异度达到0.880(表 5,图 2)。
| 因素 | AUC | 截断值 | 敏感度 | 特异度 | 约登指数 |
| APACHEⅡ+PLR 48 h | 0.792 | 0.074 | 0.718 | 0.780 | 0.498 |
| APACHEⅡ+LMR 24 h | 0.715 | 0.474 | 0.795 | 0.600 | 0.395 |
| APACHEⅡ+LMR 72 h | 0.704 | 0.438 | 0.795 | 0.600 | 0.395 |
| APACHEⅡ+PLR 48h+LMR 24h+LMR 72 h | 0.833 | 0.184 | 0.667 | 0.880 | 0.547 |
| 注:APACHEⅡ评分为急性生理学及慢性健康状况评分,PLR为血小板/淋巴细胞比值,NLR为中性粒细胞/淋巴细胞比值,LMR为单核细胞/淋巴细胞比值 | |||||
|
| 图 2 APACHEⅡ及PLR、LMR不同组合对ECMO患者生存预后的ROC曲线 Fig 2 ROC curves of APACHEⅡ combined with PLR or LMR on prognosis of ECMO |
|
|
APACHEⅡ+PLR 48 h+LMR 24 h+LMR 72 h相较于其他组合而言,曲线下面积有明显提高,具有更好的诊断效能,据此可以计算每个ECMO患者死亡风险的Logit(P)=−2.2733+ 0.0887×APACHEⅡ+(−0.0092)×PLR 48 h+ 0.7683×LMR 24 h +(−0.3901)×LMR 72 h。根据最佳截断值将VA-ECMO患者分为低风险组和高风险组。结果显示高风险组急性肾损伤的发生率显著高于低风险组(P=0.001),2级急性肾损伤发生率似乎更高(P=0.015)。在出血并发症方面,高风险组的发生率也明显高于低风险组(P=0.007),特别体现在消化道出血上(P=0.006)。在其他治疗方面,高风险组机械通气(P=0.012)、连续性肾脏替代治疗(P=0.001)的使用率均显著高于低风险组,同时,出院存活率也更低(P < 0.001)(表 6)。
| 指标 | 低风险组(n=57) | 高风险组(n=32) | P值 |
| 住院时间[d,M(Q1,Q3)] | 15.0(9.0, 20.5) | 10.0(6.3, 18.0) | 0.062 |
| ECMO辅助时间[d,M(Q1,Q3)] | 6.0(4.5, 7.9) | 6.9(4.1, 11.0) | 0.139 |
| 住院期间生存例数(例,%) | 44(77.2) | 6(18.8) | < 0.001 |
| 并发症例数(例,%) | |||
| 急性肾损伤 | |||
| 1级 | 14(24.6) | 14(43.8) | 0.061 |
| 2级 | 6(10.5) | 10(31.3) | 0.015 |
| 3级 | 6(10.5) | 2(6.3) | 0.499 |
| 共计 | 26(45.6) | 26(81.3) | 0.001 |
| 感染 | |||
| 血流 | 2(3.5) | 3(9.4) | 0.249 |
| 呼吸 | 13(22.8) | 13(40.6) | 0.076 |
| 共计 | 15(26.3) | 13(40.6) | 0.163 |
| 出血 | |||
| 脑出血 | 3(5.3) | 2(6.3) | 0.846 |
| 消化道出血 | 0(0) | 4(12.5) | 0.006 |
| 呼吸道出血 | 1(1.8) | 3(9.4) | 0.096 |
| 共计 | 4(7.0) | 9(28.1) | 0.007 |
| CRRT应用例数(n, %) | 28(49.1) | 27(84.4) | 0.001 |
| 机械通气应用例数(n, %) | 38(66.7) | 29(90.6) | 0.012 |
| IABP应用例数(n, %) | 13(22.8) | 12(37.5) | 0.139 |
作为一种生命支持技术,VA-ECMO能快速且有效地为急性循环衰竭或心源性休克患者提供体外循环帮助,在急危重症患者抢救治疗中起到无可替代的作用[10],但其尚存在诸多局限性及相关并发症。感染、出血、肾功能损伤、神经功能障碍是ECMO辅助治疗期间常见的几大并发症,也是影响患者预后效果的重要危险因素[5]。其中以出血并发症最为常见。在一项514例VA-ECMO患者的研究中,出血率为70.2%[11]。ECMO建立前危重患者由于组织低灌注而使机体处于强烈的应激状态,ECMO建立后一方面患者血液与体外ECMO回路的异物接触,另一方面由于需要应用肝素进行全身的抗凝,易造成凝血功能失调和免疫系统激活,反过来加重出血或凝血并发症,如中风或肺栓塞[5, 12]。因此,积极探索ECMO炎症相关指标,有助于ECMO患者的病情判断和风险预后评估,进而指导临床决策。
目前尚无明确的临床血液指标评估ECMO患者的临床预后情况。PLR、NLR、LMR作为新型血炎症指标[13],相较于单独的血细胞计数能更加稳定地反映机体炎症反应状态,正逐步应用于各种疾病病理生理及发生发展的研究中,在急危重症领域也受到越来越多的关注。APACHEⅡ是目前临床普遍采用的危重症患者病情评估系统,评分越高者病情越重,病死率也越高[14]。既往研究表明,APACHEⅡ评分系统在ECMO治疗心源性休克患者方面具备判断预后的价值[15]。本研究中死亡组与存活组中APACHEⅡ评分四分位数间距分别为33.0(26.0, 37.0)、20.0(16.5, 33.0),死亡组评分显著高于存活组。以截断值为25.5时,APACHEⅡ评分的敏感度为0.795,特异度为0.6,对判断ECMO预后有一定的预测价值。本文首次尝试将ECMO上机前APACHEⅡ评分与治疗前后各个时间点的血细胞亚型比值联合起来,通过ROC曲线获得各联合诊断的截断值,兼顾了敏感度和特异度,很大程度上提高了所得结果的客观性,通过建立基于各个变量的预后风险评估模型,更加全面且特异地评估患者的病情及临床预后。
本研究重点分析了在ECMO上机前各基线指标以及ECMO上机前后早期PLR、NLR、LMR在各个时间点的分布情况。单因素分析提示,上机前APACHEⅡ、PLR 48 h,LMR 24 h以及LMR 72 h是ECMO患者出院存活的危险因素,多因素分析也显示这些变量也是影响ECMO患者28 d生存率的独立危险因素,ROC曲线显示APACHEⅡ、PLR 48 h、LMR 24 h、LMR 72 h曲线下面积分别为0.710、0.776、0.713、0.654。本文在APACHEⅡ评分的基础上,分别与其他几个变量进行不同组合,结果显示,APACHEⅡ+PLR 48 h、APACHEⅡ+LMR 24h、APACHEⅡ+LMR 72 h、APACHEⅡ+PLR 48h+LMR 24 h+LMR 72 h四种不同组合对VA-ECMO患者生存预后诊断的AUC分别为0.792、0.715、0.704、0.833,相对单一指标而言,曲线下面积有明显提高,其中,四者联合预测死亡AUC(0.833)值最大,特异度0.880,敏感度0.667,具有更好的预测价值。更进一步,根据APACHEⅡ联合PLR 48 h、LMR 24 h、LMR 72 h四个变量的预后模型,将患者分为低风险组及高风险组,进一步得出高风险组患AKI的风险更高,且易出现消化道出血等并发症,使用机械通气、CRRT等治疗较多,最重要的是其病死率也更高。APACHEⅡ联合早期各血细胞亚型比值更有助于判断VA-ECMO患者的病情并及时调整治疗措施,从而改善患者预后。
这项研究存在以下局限性。首先,本研究为单中心小样本回顾性研究,结论有待大样本前瞻性研究进一步验证。其次,本文仅分析了VA-ECMO上机后28 d生存率,生存期考察时间较短,有一定的选择偏倚,限制了结果的通用性。值得一提的是,本研究首次将PLR、LMR及APACHEⅡ联合用于VA-ECMO这一特殊群体,证实了其对VA-ECMO患者临床预后具有较好的诊断价值。另外,这些指标常规监测且费用低廉,体现了良好的临床应用价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 安迪、朱轶、张忠满:研究设计、数据收集;安迪、邹乐、丁涛:数据整理、统计学分析;陈旭锋、李伟:体外膜肺氧合专业指导、基金支持;安迪、徐微笑:论文撰写、论文修改
| [1] | Gattinoni L, Carlesso E, Langer T. Clinical review: extracorporeal membrane oxygenation[J]. Crit Care, 2011, 15(6): 243. DOI:10.1186/cc10490 |
| [2] | Köse N, Yıldırım T, Akın F, et al. Prognostic role of NLR, PLR and LMR in patients with pulmonary embolism[J]. Bosn J Basic Med Sci, 2020, 20(2): 248-253. DOI:10.17305/bjbms.2019.4445 |
| [3] | Zhao CY, Wei Y, Chen DY, et al. Prognostic value of an inflammatory biomarker-based clinical algorithm in septic patients in the emergency department: an observational study[J]. Int Immunopharmacol, 2020, 80: 106145. DOI:10.1016/j.intimp.2019.106145 |
| [4] | Nøst TH, Alcala K, Urbarova I, et al. Systemic inflammation markers and cancer incidence in the UK Biobank[J]. Eur J Epidemiol, 2021, 36(8): 841-848. DOI:10.1007/s10654-021-00752-6 |
| [5] | Millar JE, Fanning JP, McDonald CI, et al. The inflammatory response to extracorporeal membrane oxygenation (ECMO): a review of the pathophysiology[J]. Crit Care, 2016, 20(1): 387. DOI:10.1186/s13054-016-1570-4 |
| [6] | 孙峰, 陈旭锋, 张劲松, 等. 静脉-动脉体外膜氧合治疗的严重心源性休克患者早期容量平衡与预后分析[J]. 中华急诊医学杂志, 2021, 30(10): 1182-1186. DOI:10.3760/cma.j.issn.1671-0282.2021.10.004 |
| [7] | Ling JY, Li CS, Zhang Y, et al. Protective effect of extracorporeal membrane pulmonary oxygenation combined with cardiopulmonary resuscitation on post-resuscitation lung injury[J]. World J Emerg Med, 2021, 12(4): 303-308. DOI:10.5847/wjem.j.1920-8642.2021.04.009 |
| [8] | Feng MX, Lu YQ. Performance of extracorporeal membrane oxygenation in patients with fatal paraquat poisoning: grasp for straws?[J]. World J Emerg Med, 2021, 12(3): 232-234. DOI:10.5847/wjem.j.1920-8642.2021.03.013 |
| [9] | 张忠满, 陈旭锋, 张劲松, 等. 急性暴发性心肌炎患者体外膜肺氧合治疗后左心收缩功能观察研究[J]. 中华急诊医学杂志, 2020, 29(2): 213-216. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0017 |
| [10] | Bonicolini E, Martucci G, Simons J, et al. Limb ischemia in peripheral venous-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment[J]. Crit Care, 2019, 23(1): 266. DOI:10.1186/s13054-019-2541-3 |
| [11] | Dalton HJ, Reeder R, Garcia-Filion P, et al. Factors associated with bleeding and thrombosis in children receiving extracorporeal membrane oxygenation[J]. Am J Respir Crit Care Med, 2017, 196(6): 762-771. DOI:10.1164/rccm.201609-1945OC |
| [12] | Lidegran MK, Mosskin M, Ringertz HG, et al. Cranial CT for diagnosis of intracranial complications in adult and pediatric patients during ECMO: clinical benefits in diagnosis and treatment[J]. Acad Radiol, 2007, 14(1): 62-71. DOI:10.1016/j.acra.2006.10.004 |
| [13] | Osadnik T, Bujak K, Osadnik K, et al. Novel inflammatory biomarkers may reflect subclinical inflammation in young healthy adults with obesity[J]. Endokrynol Pol, 2019, 70(2): 135-142. DOI:10.5603/EP.a2019.0002 |
| [14] | Qiu JK, Wang CH, Pan XH, et al. APACHE-Ⅱ score for anti-tuberculosis tolerance in critically ill patients: a retrospective study[J]. BMC Infect Dis, 2019, 19(1): 106. DOI:10.1186/s12879-019-3751-7 |
| [15] | Chung SY, Sheu JJ, Lin YJ, et al. Outcome of patients with profound cardiogenic shock after cardiopulmonary resuscitation and prompt extracorporeal membrane oxygenation support. A single-center observational study[J]. Circ J, 2012, 76(6): 1385-1392. DOI:10.1253/circj.cj-11-1015 |
 2022, Vol. 31
2022, Vol. 31




