脑卒中是全球首要的致死和致残性疾病, 是主要威胁人类健康的疾病之一。急性缺血性脑卒中(acute ischemic stroke,AIS)是最常见的卒中类型, 占我国脑卒中的69.6%~70.8%。AIS可引起脑组织缺血、缺氧及脑水肿,导致相关神经损伤和神经体液调节功能紊乱等,并引发多种并发症。临床上将既往无心脏病史,因脑卒中导致的神经功能缺损,而直接引发的心脏功能紊乱定义为脑心综合症(cerebral cardiac syndrome, CCS)[1]。多数医生在卒中治疗过程中,主要关注在神经系统治疗和康复上,对卒中患者合并的心脏问题关注不够。因此,对CCS的发生、发展规律认识,发现高危患者并及时采取防范措施就显得尤为重要。本研究收集AIS的临床资料,分析AIS后并发CCS的临床特点及相关危险因素,以进一步认识CCS的临床特点、发生和发展规律。
1 资料与方法 1.1 一般资料采用病例对照研究方法,通过首都医科大学附属北京同仁医院电子病案系统,回顾性检索2019年1月至2021年5月因AIS收住急诊和神经内科监护病房的患者,AIS诊断标准参照《中国急性缺血性脑卒中诊治指南2014》[2]。CCS诊断标准[3-5]: ①既往无心脏病病史;②急性脑卒中诊断明确;③出现继发性心脏损害表现,包括各种心律失常和心电图改变,急性心力衰竭甚至肺水肿,心肌缺血甚至心肌梗死,心肌酶谱异常。根据卒中后是否发生CCS,将患者分为CCS组和对照组。该研究通过北京同仁医院伦理委员会审批,审批号TREC2022-KY033。
纳入标准:(1) AIS经磁共振成像或计算机断层扫描证实;(2)发病72 h内来诊并接受治疗者;(3)来诊后24 h内完成心电图及心肌酶谱检查结果者;(4)住院时间不少于10 d,同时有住院10 d内的心电图监护记录。排除标准:(1)短暂性脑缺血发作、出血性卒中患者;(2)伴心脏、血液病、自身免疫性疾病以及严重的肝脏、肺及肾脏系统基础疾病者;(3)伴有严重感染性疾病、严重的电解质紊乱、凝血功能障碍者;(4)卒中发病前1周服用过抗心律失常药物者。
1.2 数据收集收集入组患者的基线资料,包括性别、年龄、糖尿病、高血压病、慢性阻塞性肺疾病、阻塞性睡眠呼吸暂停低通气综合征等基础疾病、吸烟史、饮酒史等。记录卒中病变部位,分为脑叶、小脑、基底节、脑干和丘脑。并记录入院时每位患者的NIHSS评分结果, 心肌酶学和心肌肌钙蛋白I(troponin I, TNI)及心电图评估。
比较两组性别、年龄、高血压病史、糖尿病史、慢性阻塞性肺疾病、慢性肾脏病、饮酒史、吸烟史以及梗塞部位有无差异。
1.4 统计学方法采用SPSS 17.0统计软件。符合正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验;计数资料采用百分比表示,两组间比较采用χ2检验。用二元Logistic回归分析CCS发生的相关危险因素。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况共纳入196例AIS患者,其中男110例,女86例,年龄(75.2±8.1)岁。CCS组92例,占46.9%;对照组104例。
2.2 CCS的临床特点在92例CCS组患者中有74例(80.4%)患者在AIS事件后72 h内发生,15例(16.3%)在72 h~1周内发生,3例(3.2%)发生于1周以后。同一患者心电图可出现一种或几种ECG异常,本组92例中心肌缺血ST-T改变52例,Q-T间期延长9例,明显U波4例,心律失常51例,窦性心动过速15例,窦性心动过缓9例,房性早博6例,室性早博3例,传导阻滞8例,房颤5例;假性心梗3例,急性心梗2例。有25例TNI和心肌酶同时升高,有12例仅TNI升高,10例仅心肌酶升高。
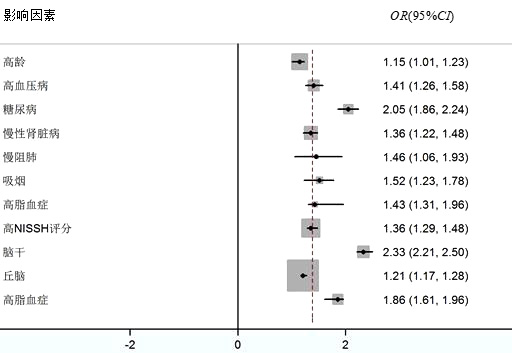
2.3 CCS的危险因素对单因素分析中差异有统计学意义的变量进行二元Logistic回归分析结果(见表 1),发现高龄、高血压、糖尿病、慢性肾病、慢性阻塞性肺病、吸烟史、饮酒史、高美国国立卫生研究院卒中量表(the National Institutes of Health Stroke Scale, NISSH评分)、脑干梗死、丘脑梗死等与卒中后CCS的发生相关(见图 1)。
| 指标 | 总数(n=196) | CCS组(n=92) | 对照组(n=104) | P值 |
| 年龄(岁,x±s) | 81.55±13.48 | 87.54±7.72 | 75.80±15.25 | < 0.001 |
| 女性(n, %) | 68(34.7) | 29(31.5) | 39(37.5) | 0.196 |
| 高血压(n, %) | 135(68.9) | 81(88.0) | 54(51.9) | < 0.001 |
| 糖尿病(n, %) | 66(33.7) | 45(48.9) | 21(20.2) | < 0.001 |
| 慢性肾脏病(n, %) | 36(18.4) | 20(21.7) | 16(15.4) | 0.041 |
| 慢性阻塞性肺疾病(n, %) | 40(20.4) | 22(23.9) | 18(17.3) | 0.033 |
| 吸烟史(n, %) | 39(19.9) | 23(25.0) | 16(15.4) | 0.288 |
| 饮酒史(n, %) | 23(11.7) | 14(15.2) | 9(8.6) | 0.273 |
| NISSH评分(分,x±s) | 8.15±2.92 | 9.18±2.09 | 7.16±3.25 | < 0.001 |
| 脑梗死部位(n, %) | ||||
| 脑叶 | 52(26.5) | 25(27.1) | 27(25.7) | 0.090 |
| 小脑 | 14(7.1) | 7(7.6) | 7(6.7) | 0.569 |
| 基底节 | 70(35.7) | 32(34.8) | 38(36.5) | 0.367 |
| 脑干 | 12(6.1) | 10(10.9) | 2(1.9) | 0.014 |
| 丘脑 | 30(15.3) | 18(19.6) | 12(11.5) | 0.003 |
| 高脂血症(n, %) | 86(43.9) | 54(58.7) | 32(30.8) | 0.001 |
|
| 图 1 脑心综合征相关危险因素的二元Logistic回归分析结果 Fig 1 Binary logistic regression analysis of risk factors related to cerebral heart syndrome |
|
|
本研究显示46%的AIS患者合并CCS,CCS是AIS后极易引发的并发症,CCS多在AIS后72 h内发生。与杨伟华[6]研究一致,AIS后急性期心脏并发症表现多样且严重程度不等,AIS后心电图缺血性改变、心律失常很常见[7],还有传导缺陷和复极异常[8],以及心肌损伤[9], 甚至恶性心律失常和猝死。本组CCS心电图主要表现以心肌缺血的发生率最高,而后分别为心律失常、假性心梗和急性心梗。心律失常中窦性心动过速、心房纤颤最为常见,此外还有异常U波、QTc间期延长、心房扑动、房性早搏、心室性早搏、束支传导阻滞、假性心梗和急性心梗等。研究表明CCS是脑卒中后常见的并发症,不仅与短期和长期病死率、认知功能受损[10]、还与未来的心血管事件发生风险密切相关[11]。欧洲心脏病学会的共识认为心脏病专家需要参与到卒中病房,以解决急性卒中患者的心血管方面的问题[12]。
TNI是临床广泛用于量化识别心肌损伤的特异和敏感的生物标记物。本组研究中发现高达50%的CCS患者TNI升高,与之前研究相一致[13],且多在AIS事件后48 h内出现。2018美国心脏协会有关缺血性卒中的指南指出心肌损伤在AIS后频繁出现,并与神经功能预后差和住院病死率增加密切相关,推荐在急性期应监测TNI,但对于TNI升高的卒中患者如何正确解读和管理目前还没有确定的方案[14]。在一项小样本的观察研究中发现,约有四分之一TNI升高的CCS患者,在冠状动脉造影中发现有冠状动脉病变的证据,而近一半的患者尽管有TNI升高,却没有冠状动脉病变的证据[15]。
心脑血管疾病具有相同的危险因素和病理生理基础,其合并发生率较高且常常互为并发症,导致了两者经常同时或者相继发病。练海娟等[4]从实验室检测结果的角度经分析发现,高龄、高NIHSS评分,以及B型脑钠肽、乳酸脱氢酶、葡萄糖、中性粒细胞升高和凝血酶原时间、活化部分凝血活酶时间延长等是CCS的独立危险因素[16]。本研究显示高龄、高血压病、糖尿病、慢性肾脏病、慢性阻塞性肺病、高脂血症等是AIS后CCS的相关危险因素。宋剑平等[16]研究表明颈动脉狭窄与心血管病变、脑卒中有着密切的关系,颈动脉狭窄组的患者脑心综合征的风险明显高于非狭窄组。由此可见AIS患者可能已经存在动脉粥样硬化以及脏器的慢性缺血,因此卒中后的心脏病问题也可能是由于系统功能障碍(炎症和免疫反应)引起的血管损伤,而不完全来源于神经功能受损,尽管脑损伤可能会加重心脏功能异常。
梗死部位在脑叶、小脑、基底节、脑干和丘脑部位的患者CCS的发生率分别为28.8%、50.0%、40.0%、83.3%、60.0%、70.0%。在脑干梗死和丘脑梗死中CCS发生率较高,明显高于脑叶、小脑、基底节。研究表明大脑皮质、白质多种神经结构分布相对分散,该部位的小灶性AIS一般不会出现植物神经功能障碍而导致心脏活动异常。梗死部位靠近中线者易引起自主神经调节障碍,引发CCS发生。有研究表明卒中后心肌细胞沿心内神经纤维走向,呈局灶性溶解或坏死,提示卒中后心肌损伤为神经源性心肌损伤[17]。进一步证明了CCS发生的相关神经因素。
综上所述,CCS是AIS后常见并发症,发生CCS风险不仅取决于患者的冠状动脉疾病的既有危险因素,还取决于患者的卒中部位和神经功能受损程度。在急性脑卒中的治疗过程中要注意心脏的保护,避免快速补液和应用加重心脏负担的药物。对于急性卒中患者,应尽早进行心电图、心肌酶、TNI、血清脑钠肽等心脏指标进行监测,并将此理念贯彻到卒中患者的随访过程中,及早发现卒中患者的心脏问题,以预防卒中后的不良心脏事件。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杜庆霞、张敬:数据收集、论文撰写;李杰宾、丁宁:数据收集及整理、统计学分析;杜庆霞、丁宁:研究设计、论文修改
| [1] | Scheitz JF, Nolte CH, Doehner W, et al. Stroke-heart syndrome: clinical presentation and underlying mechanisms[J]. Lancet Neurol, 2018, 17(12): 1109-1120. DOI:10.1016/S1474-4422(18)30336-3 |
| [2] | 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-257. DOI:10.3760/cma.j.issn.1006-7876.2015.04.002 |
| [3] | Mierzewska-Schmidt M, Gawecka A. Neurogenic stunned myocardium - do we consider this diagnosis in patients with acute central nervous system injury and acute heart failure?[J]. Anaesthesiol Intensive Ther, 2015, 47(2): 175-180. DOI:10.5603/AIT.2015.0017 |
| [4] | 练海娟, 沈旭慧, 陈金花, 等. 脑心综合征危险因素分析及风险预测模型研究[J]. 中华急诊医学杂志, 2019, 28(11): 1417-1422. DOI:10.3760/cma.j.issn.1671-0282.2019.11.016 |
| [5] | 李洋阳, 郎野, 孟然. 急性脑梗死脑心综合征发生的时间规律及其持续时间与临床预后的关系[J]. 中华老年心脑血管病杂志, 2016, 18(10): 1061-1065. |
| [6] | 杨伟华. 急性脑卒中并发脑心综合征的临床特征分析[J]. 中国现代医药杂志, 2016(12): 72-73. DOI:10.3969/j.issn.1672-9463.2016.12.024 |
| [7] | Fernández-Menéndez S, García-Santiago R, Vega-Primo A, et al. Arritmias cardiacas en la unidad de ictus: análisis de los datos de la monitorización cardiaca[J]. Neurología, 2016, 31(5): 289-295. DOI:10.1016/j.nrl.2015.03.013 |
| [8] | Kallmünzer B, Breuer L, Kahl N, et al. Serious cardiac arrhythmias after stroke[J]. Stroke, 2012, 43(11): 2892-2897. DOI:10.1161/strokeaha.112.664318 |
| [9] | Ay H, Koroshetz WJ, Benner T, et al. Neuroanatomic correlates of stroke-related myocardial injury[J]. Neurology, 2006, 66(9): 1325-1329. DOI:10.1212/01.wnl.0000206077.13705.6d |
| [10] | Broersen LHA, Siegerink B, Sperber PS, et al. High-sensitivity cardiac troponin T and cognitive function in patients with ischemic stroke[J]. Stroke, 2020, 51(5): 1604-1607. DOI:10.1161/STROKEAHA.119.028410 |
| [11] | Scheitz JF, Pare G, Pearce LA, et al. High-sensitivity cardiac troponin T for risk stratification in patients with embolic stroke of undetermined source[J]. Stroke, 2020, 51(8): 2386-2394. DOI:10.1161/STROKEAHA.120.029628 |
| [12] | Collaborators GBD2S. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(5): 439-458. DOI:10.1016/S1474-4422(19)30034-1 |
| [13] | Scheitz JF, Mochmann HC, Erdur H, et al. Prognostic relevance of cardiac troponin T levels and their dynamic changes measured with a high-sensitivity assay in acute ischaemic stroke: analyses from the TRELAS cohort[J]. Int J Cardiol, 2014, 177(3): 886-893. DOI:10.1016/j.ijcard.2014.10.036 |
| [14] | Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2018, 49(3): e46-e110. DOI:10.1161/STR.0000000000000158 |
| [15] | Mochmann HC, Scheitz JF, Petzold GC, et al. Coronary angiographic findings in acute ischemic stroke patients with elevated cardiac troponin: the troponin elevation in acute ischemic stroke (TRELAS) study[J]. Circulation, 2016, 133(13): 1264-1271. DOI:10.1161/CIRCULATIONAHA.115.018547 |
| [16] | 宋剑平, 孔雪, 封秀琴, 等. 急性脑卒中患者颈动脉狭窄与脑心综合征风险的队列研究[J]. 中华急诊医学杂志, 2019, 28(8): 1034-1036. DOI:10.3760/cma.j.issn.1671-0282.2019.08.021 |
| [17] | Bieber M, Werner RA, Tanai E, et al. Stroke-induced chronic systolic dysfunction driven by sympathetic overactivity[J]. Ann Neurol, 2017, 82(5): 729-743. DOI:10.1002/ana.25073 |
 2022, Vol. 31
2022, Vol. 31




