嗜血细胞综合征(hemophagocytic syndrome,HPS)是一种由巨噬细胞、T细胞和NK细胞异常活化导致的过度炎症反应综合征[1],成人HPS常由感染、肿瘤性疾病或自身炎症/自身免疫性疾病所致[2]。临床上可以表现为发热、血细胞减少、脾肿大、血清铁蛋白(serum ferritin, SF)升高、甘油三酯(triglyceride, TG)升高、纤维蛋白原(fibrinogen, FIB)降低、自然杀伤(natural killer cells, NK)细胞活性减低,可溶性白介素-2受体(sCD25)水平升高等[3],发病机制与淋巴细胞毒性和免疫调节异常相关,其特征是不受控制的炎症反应,过度炎症细胞因子的释放[2, 4-6],最终形成恶性循环。研究证实抑制过度活跃的免疫系统在成人HPS的治疗中有着重要的意义,积极启动标准治疗(地塞米松联合依托泊苷),可以有效改善预后,降低患者病死率[7-8]。但是也有研究发现[9],过早的开始标准治疗可能会对患者明确诊断产生不利影响。2019年成人HPS治疗推荐方案中提出对继发HPS(特别是感染相关性HPS)、巨噬细胞活化综合征(免疫系统疾病相关)患者,早期可以进行单纯激素治疗,依据临床情况进行个体化治疗[2-9]。在临床工作中,笔者发现骨髓穿刺检查、NK细胞活性及sCD25等检测存在耗时较长的情况,易造成诊断及治疗延迟。激素治疗是急诊医生最容易开启的治疗手段。为了早期开始更为恰当的治疗,更好改善成人HPS患者的预后,笔者对北京大学人民医院急诊科诊断成人HPS的临床病例进行回顾性研究,分析早期激素治疗对成人HPS患者临床诊断,病情控制和临床预后的影响和意义。
1 资料与方法 1.1 研究对象本研究采用回顾性研究方法,收集本院急诊科重症监护病区2019年9月至2021年8月期间入院,诊断嗜血细胞综合征或拟诊HPS病例。入选标准:①年龄满16岁周岁的成人患者;②依据HLH-2004诊断标准(≥5项)或Hscore(≥169分)标准建立临床诊断[2]。排除标准:①开始HPS相关治疗后就诊于急诊科的患者;②临床研究数据不足以支持该研究;③长期使用糖皮质激素和细胞毒性药物的患者;④非医疗因素导致患者临床死亡。治疗应答定义为≥2种可量化症状和实验室标志物(SF、TG、丙氨酸转氨酶)改善25%以上[10]。本研究经北京大学人民医院伦理委员会批准(2022PHB043-001)。
1.2 研究方法(1)记录各组患者的一般信息:年龄、性别、疾病诊断、发热峰值、发热时间、激素治疗情况、临床预后、住院时间等;(2)收集实验室指标:血常规、生化全项、凝血分析、嗜血细胞现象、脾脏/肝脏大小、SF,均由北京大学人民医院检验科、影像科、细胞形态室测定,sCD25由海思特检验实验室通过ELISA方法进行测定,NK细胞活性由海思特检验实验室通过流式细胞术进行测定。(3)
临床分组:①依据临床预后将患者分为死亡组和生存组;②依据激素治疗情况将患者分为:提前激素治疗组(HLH-2004诊断标准为4项时开始激素治疗),标准激素治疗组(满足至少5项HLH-2004诊断标准开始激素治疗);③依据提前激素治疗患者满足4项HLH-2004诊断标准时的情况,将患者分为常规项目组(包括:发热、2/3系减低、高TG/低FIB、脾大)和非常规项目组(包括嗜血细胞现象、SF升高、NK细胞活性降低、sCD25升高中至少1项)。
比较不同组间相关指标(血常规、生化全项、凝血分析、住院时间等),评估提前激素治疗对HPS患者临床预后的影响,分析提前激素治疗对患者临床诊断建立(依据HLH-2004诊断标准)的影响,分析不同项目组提前激素治疗对患者建立诊断、相关临床指标改善和预后的影响。
1.3 统计学方法采用SPSS 25.0软件进行数据分析。符合正态分布的变量以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,非正态分布计量变量以中位数(四分位数)[M(Q1, Q3)]表示,采用非参数秩和检验进行比较;分类变量以例数(百分比)表示,采用χ2检验或Fisher精确概率法。采用Logistic单因素及多因素分析、Kaplan–Meier生存曲线评估HPS患者预后情况。以P < 0.05为差异有统计学意义。
2 结果 2.1 研究病例的基本资料纳入研究病例共34例,男性18例,女性16例,年龄17~88岁,院内死亡13例,好转出院21例。其中EB病毒相关HPS者14例、感染性疾病相关HPS者7例、免疫系统疾病相关HPS者7例、淋巴瘤相关HPS者6例。
院内死亡组患者的年龄较大,急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)-Ⅱ评分及序贯器官衰竭(sequential organ failure assessment, SOFA)评分较高,总胆红素(total bilirubin, TBil)较高,血清白蛋白(albumin, ALB)较低。HLH-2004诊断项目、肾功能、高密度脂蛋白、凝血状态、血钠、是否提前激素治疗,在两组间差异无统计学意义(表 1)。
| 指标 | 死亡组(n=13) | 生存组(n=21) | t/Z/χ2值 | P值 |
| 年龄(岁)a | 72.38±11.49 | 49.62±20.92 | 4.089 | < 0.001 |
| 性别(男)c | 6(46.2) | 12(57.1) | 0.389 | 0.533 |
| APACHEⅡ (分)a | 24.38±8.18 | 17.52±6.86 | 2.633 | 0.013 |
| SOFA (分)b | 8.00(4.50, 9.00) | 4.00(2.00, 19.00) | −2.695 | 0.007 |
| 2/3系减低(是)c | 9(69.2) | 15(71.4) | 0.019 | 0.891 |
| TG (> 3 mmol/L)c | 6(46.2) | 7(33.3) | 0.559 | 0.455 |
| FIB (≤1.5 g/L)c | 3(23.1) | 6(28.6) | 0.125 | 0.724 |
| SF (≥500 μg/L)c | 13(100.0) | 19(90.5) | — | 0.513 |
| NK细胞(< 15%)c | 4(42.9) | 9(42.9) | 0.117 | 0.733 |
| sCD25(> 6 400 ng/L)c | 10(76.9) | 13(61.9) | 0.284 | 0.594 |
| 脾大(是)c | 7(53.8) | 12(57.1) | 0.035 | 0.851 |
| 嗜血细胞现象(是)c | 3(23.1) | 7(33.3) | 0.063 | 0.802 |
| 体温峰值(℃)a | 39.18±0.32 | 39.51±0.86 | −1.328 | 0.194 |
| 发热时间(d)b | 10.00(2.50, 22.00) | 10.00(7.00, 19.00) | −0.463 | 0.643 |
| 提前激素治疗(是)c | 5(38.5) | 13(61.9) | 1.771 | 0.183 |
| ALT (U/L)b | 33.00(15.50, 64.00) | 42.00(18.00, 126.50) | −0.585 | 0.559 |
| ALB (g/L)a | 27.01±3.56 | 30.76±6.49 | −2.171 | 0.038 |
| TBil (mmol/L)b | 29.30(11.65, 63.35) | 12.40(9.95, 19.55) | −2.217 | 0.027 |
| Scr (mmol/L)b | 102.00(63.00, 158.00) | 80.00(58.00, 116.50) | −1.099 | 0.272 |
| HDL (mmol/L)b | 0.59(0.38, 0.71) | 0.51(0.35, 0.71) | −0.355 | 0.723 |
| PT (s)a | 14.51±2.97 | 12.91±1.05 | 1.806 | 0.095 |
| APTT (s)a | 32.27±5.91 | 31.06±6.84 | 0.507 | 0.616 |
| 血清钠(mmol/L)a | 133.35±9.41 | 136.40±5.75 | −1.178 | 0.248 |
| 注:a为(x±s);b为M(Q1, Q3);c为例(%);APACHEⅡ为急性生理与慢性健康状况评分Ⅱ;SOFA为序贯器官衰竭评分;TG为甘油三酯;FIB为纤维蛋白原;SF为血清铁蛋白;NK细胞为自然杀伤细胞;sCD25为可溶性白细胞介素-2受体;ALT为丙氨酸转氨酶;ALB为血清白蛋白;TBil为总胆红素;Scr为血肌酐;HDL为高密度脂蛋白;PT为凝血酶原时间;APTT为活化部分凝血活酶时间 | ||||
单因素Logistic分析纳入年龄、APACHEⅡ评分、SOFA评分、TBil、ALB、提前激素治疗策略,结果显示年龄(OR=1.098,95%CI: 1.019~1.183,P=0.014),APACHEⅡ评分(OR=1.144,95%CI: 1.017~1.285,P=0.024),SOFA评分(OR=1.441,95%CI: 1.079~1.925,P=0.013)与患者死亡风险相关。多因素Logistic分析纳入年龄、SOFA评分、ALB、提前激素治疗策略,结果显示年龄(OR=1.099,95%CI: 1.014~1.190,P=0.021)与患者死亡风险相关,提前激素治疗与患者临床预后无统计学相关(表 2)。Kaplan-Meier生存曲线显示,与标准激素治疗相比,两组患者60 d生存率差异无统计学意义(图 1)。
| 变量 | 单因素分析 | 多因素分析 | |||||
| OR | 95%CI | P值 | OR | 95%CI | P值 | ||
| 年龄(岁) | 1.098 | 1.019~1.183 | 0.014 | 1.099 | 1.014~1.190 | 0.021 | |
| APACHEⅡ(分) | 1.144 | 1.017~1.285 | 0.024 | - | |||
| SOFA (分) | 1.441 | 1.079~1.925 | 0.013 | 1.394 | 0.993~1.957 | 0.055 | |
| TBil (mmol/L) | 1.031 | 0.999~1.065 | 0.059 | - | |||
| ALB (g/L) | 0.874 | 0.754~1.105 | 0.077 | 0.915 | 0.704~1.188 | 0.915 | |
| 提前激素治疗(是) | 2.600 | 0.627~10.786 | 0.188 | 0.739 | 0.103~5.313 | 0.764 | |
| 注:APACHEⅡ为急性生理与慢性健康状况评分Ⅱ;SOFA为序贯器官衰竭评分;ALB为血清白蛋白;TBil为总胆红素 | |||||||
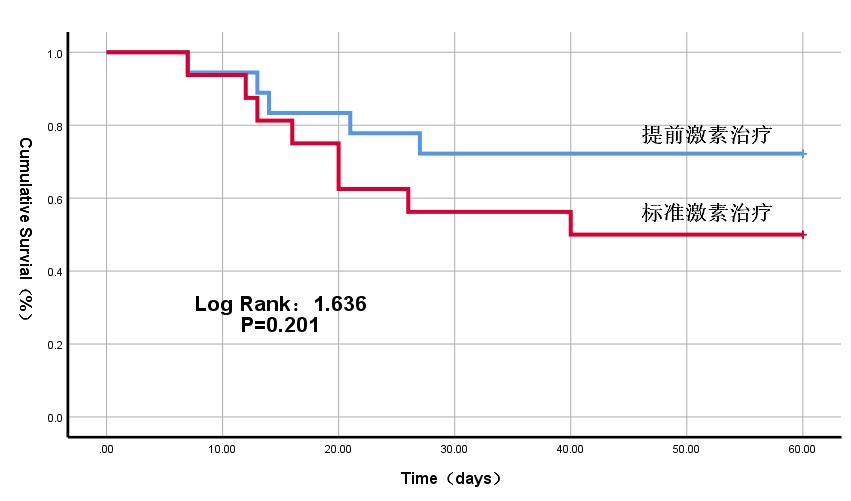
|
| 图 1 提前激素治疗对患者60 d生存率的生存曲线分析 Fig 1 Kaplan-Meier curves analysis of 60-day survival of patients treated with advance hormone therapy |
|
|
研究中18例患者满足HLH-2004诊断标准4项即开始提前激素治疗,16例患者满足≥5项标准时开始标准激素治疗,具体情况如下(图 3)。提前激素治疗前后HLH-2004诊断标准达标情况的对比显示(NK细胞活性、sCD25、嗜血细胞现象检查未进行二次复查,未纳入分析):全部18例患者均满足Hscore≥169分标准,激素治疗5~7 d后复查TG水平仍继续升高,满足HLH-2004诊断标准项目数明显增加(表 3),治疗后未满足HLH-2004诊断达标(≥5项标准)共3例,占提前激素治疗总病例数的16.7%。
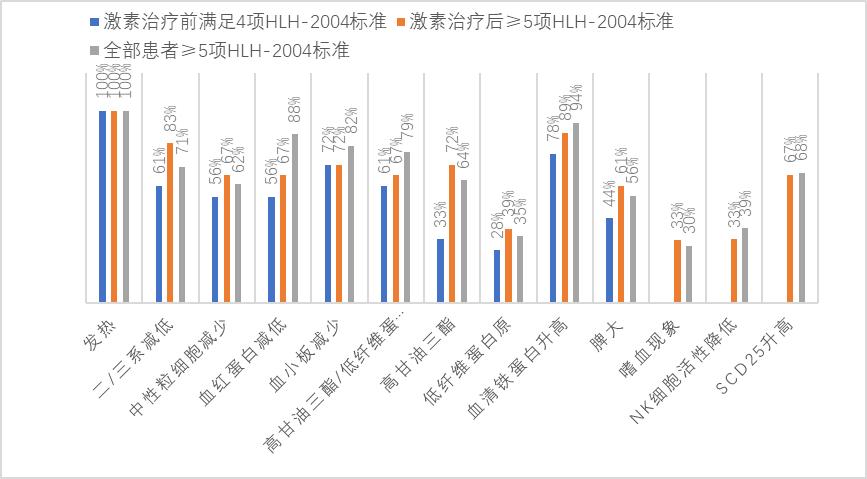
|
| 图 3 HLH-2004诊断标准各项指标达标情况 Fig 3 The achievement of each index of HLH-2004 diagnostic criteria |
|
|
| 指标 | 治疗前(n=18) | 治疗后(n=18) | t/Z/χ2值 | P值 |
| HLH-2004 (项)a | 4.00±0.00 | 5.44±0.98 | −6.23 | < 0.001 |
| HScore (分)a | 205.78±40.11 | 202.22±33.87 | 0.287 | 0.776 |
| 2/3系减少(是)c | 11(61.1) | 15(83.3) | 1.246 | 0.264 |
| NEU (< 1×109/L)c | 10(55.6) | 12(66.7) | 0.117 | 0.732 |
| NEU (109/L)b | 1.74(0.61, 7.11) | 3.52(1.48, 6.86) | −0.858 | 0.391 |
| HGB (< 90 g/L)c | 10(55.6) | 14(77.8) | 1.125 | 0.289 |
| HGB (g/L)a | 94.94±36.80 | 91.29±26.09 | 0.337 | 0.738 |
| PLT (< 100×109/L)c | 13(72.2) | 13(72.2) | 0.000 | 1.000 |
| PLT (109/L)b | 69.00(30.75, 101.50) | 63.00(31.50, 119.00) | −0.099 | 0.921 |
| 脾大(是)c | 8(44.4) | 11(61.1) | 0.446 | 0.504 |
| 高TG或低FIB(是)c | 11(61.1) | 12(66.7) | 0.120 | 0.729 |
| TG (> 3 mmol/L)c | 6(33.3) | 13(72.2) | 4.012 | 0.045d |
| TG (mmol/L)a | 3.09±1.27 | 3.64±1.25 | −1.196 | 0.241 |
| FIB (< 1.50 g/L)c | 5(27.8) | 7(38.9) | 0.125 | 0.724 |
| FIB (g/L)b | 2.85(1.37, 4.27) | 2.23(1.33, 3.11) | −1.188 | 0.235 |
| SF (> 0.5 mg/L)c | 14(77.8) | 16(88.9) | 0.200 | 0.655 |
| SF (mg/L) b | 4.18(1.214, 42.84) | 2.92(2.06, 5.84) | −0.598 | 0.550 |
| 注:a为x±s;b为M(Q1, Q3);c为例(%);d为P<0.05;APACHEⅡ为急性生理学与慢性健康状况评分Ⅱ;SOFA为序贯器官衰竭评分;TG为甘油三酯;FIB为纤维蛋白原;SF为血清铁蛋白;NK细胞为自然杀伤细胞;sCD25为可溶性白细胞介素-2受体 | ||||
提前激素治疗组与标准激素治疗组患者临床指标及治疗后临床指标对比提示,5~7 d后提前激素治疗组患者的凝血酶原时间(prothrombin time, PT)和活化部分凝血活酶时间(activited partial thomboplastin time, APTT)较短,更接近正常水平,住院时间更短,两组治疗后APACHE Ⅱ评分、SOFA评分、1周后治疗应答、院内死亡及其他临床指标差异无统计学意义(表 4)。
| 指标 | 提前激素治疗(n=18) | 标准激素治疗(n=16) | t/Z/χ2值 | P值 |
| 体温控制时间(d)a | 4.00(1.00, 11.50) | 6.50(2.00, 12.75) | −0.764 | 0.445 |
| APACHE Ⅱ(分)a | 13.00(7.75, 21.25) | 20.50(11.75, 27.00) | −1.780 | 0.075 |
| SOFA (分)a | 3.50(2.00, 7.000) | 5.00(3.00, 6.00) | −0.226 | 0.821 |
| ALT (U/L)a | 37.00(21.00, 73.00) | 27.00(14.25, 81.75) | −0.487 | 0.626 |
| TBil (mmol/L)a | 14.20(10.10, 24.80) | 19.70(11.83, 32.20) | −1.063 | 0.288 |
| Scr (mmol/L)a | 67.50(54.00, 96.75) | 61.00 (49.00, 171.00) | −0.020 | 0.984 |
| HDL (mmol/L)a | 0.42(0.40, 0.64) | 0.54(0.31, 0.69) | −0.146 | 0.884 |
| ALB (g/L)b | 31.12±6.02 | 28.60±4.43 | 1.365 | 0.182 |
| PT (s)b | 12.25±2.10 | 15.11±2.73 | −3.391 | 0.002 |
| APTT (s)b | 29.84±4.99 | 35.87±9.92 | −2.225 | 0.033 |
| 血清钠(mmol/L)b | 138.71±7.61 | 141.08±7.61 | −0.726 | 0.474 |
| 治疗应答(是)c | 5(27.8) | 5(31.3) | 0.049 | 0.824 |
| 住院时间(d)a | 11.50(6.75, 20.25) | 20.00 (12.00, 28.50) | −2.024 | 0.043 |
| 院内死亡(是)c | 5(27.8) | 8(50.0) | 1.771 | 0.183 |
| 注:a为M(Q1, Q3);b为x±s;c为例(%);APACHEⅡ为急性生理学与慢性健康状况评分Ⅱ;SOFA为序贯器官衰竭评分;ALT为丙氨酸转氨酶;ALB为血清白蛋白;TBil为总胆红素;Scr为血肌酐;HDL为高密度脂蛋白;PT为凝血酶原时间;APTT为活化部分凝血活酶时间 | ||||
提前激素治疗常规项目组和非常规项目组临床指标及治疗前后临床指标对比显示:APACHE Ⅱ评分、SOFA评分、建立诊断、治疗应答、临床预后及激素治疗后相关临床指标差异无统计学意义(表 5)。
| 指标 | 常规项目(5例) | 非常规项目(13例) | t/Z/χ2值 | P值 |
| 治疗后HLH-2004 (项)a | 6.00±0.71 | 5.31±0.95 | 1.473 | 0.160 |
| 治疗前HScore (分)a | 231.60±33.59 | 195.85±38.96 | 1.803 | 0.090 |
| 治疗后HScore (分)a | 201.40±36.51 | 199.58±34.11 | 0.098 | 0.923 |
| 治疗前APACHEⅡ(分)a | 17.80±7.39 | 18.69±6.58 | −0.250 | 0.806 |
| 治疗后APACHEⅡ(分)a | 13.00(8.00, 29.50) | 13.00(7.50, 18.50) | −0.445 | 0.656 |
| 治疗前SOFA (分)b | 5.00(3.50, 8.00) | 3.00(2.00, 6.50) | −1.301 | 0.193 |
| 治疗后SOFA (分)b | 3.00(2.00, 9.00) | 4.00(2.00, 7.00) | −0.498 | 0.619 |
| 体温控制时间(d)b | 3.00(1.00, 20.00) | 5.00(1.00, 7.00) | −0.175 | 0.861 |
| 治疗后ALT(U/L)b | 36.00(24.00, 53.50) | 42.00(18.50, 97.75) | −0.422 | 0.673 |
| 治疗后ALB(g/L)a | 33.56±5.35 | 30.11±6.20 | 1.084 | 0.296 |
| 治疗后TBil (mmol/L)b | 16.00(10.70, 53.10) | 14.05(9.60, 20.48) | −0.738 | 0.460 |
| 治疗后Scr (mmol/L)b | 68.00(56.00, 83.00) | 67.50(54.00, 124.75) | −0.182 | 0.855 |
| 治疗后HDL (mmol/L)a | 0.61±0.27 | 0.50±0.20 | 0.794 | 0.444 |
| 治疗后PT (s)a | 13.08±2.97 | 11.90±1.66 | 0.835 | 0.441 |
| 治疗后APTT (s)a | 33.28±4.58 | 28.41±4.58 | 1.997 | 0.064 |
| 治疗后血清钠(mmol/L)a | 133.50±4.89 | 139.93±8.12 | −1.113 | 0.284 |
| 治疗应答(是)c | 2(40.0) | 3(23.1) | — | 0.583 |
| 住院时间(d)b | 13.00(8.50, 32.00) | 7.00(5.50, 17.00) | −1.095 | 0.274 |
| 院内死亡(是)c | 2(40.0) | 3(23.1) | — | 0.583 |
成人HPS在临床上常依据HLH-2004诊断标准建立诊断,但是许多HPS患者在疾病发生早期并不能符合HLH-2004诊断标准[11],研究发现大约17%的原发性HPS患者存在不完整或非典型的临床表现[12],嗜血细胞现象、骨髓穿刺活检在疾病早期同样是非特异性表现,其临床意义存在争议[13-14]。HPS很大程度与T淋巴细胞、巨噬细胞活化及炎症因子释放相关[15],诊断和治疗延迟会导致不良预后的出现[16]。既往HPS的诊断和治疗往往都是延迟的,随着对HPS认知的提高,不适当的诊断和治疗也随之出现,增加了有害的免疫抑制[9]。HPS的治疗重点是抑制过度活跃的免疫系统和针对病因的治疗,HPS患者初始的地塞米松联合依托泊苷方案可以降低患者临床病死率[8],在患者确诊HPS后应尽快启动标准治疗。严重感染、免疫系统疾病、血液系统恶性肿瘤的患者可能因为符合HPS诊断标准启动治疗,导致有害的免疫抑制和不适当治疗的出现[12](直到原发的疾病表现变得更加明显)。有学者认为对于非重症HPS患者,将早期单纯地塞米松治疗联合严密临床指标监测作为初始治疗方案更为合适[9]。研究证实继发HPS(特别是感染相关性HPS)、巨噬细胞活化综合征患者早期的单纯激素治疗是可行的,可以依据临床情况评估,个体化选择治疗时机和治疗方案[2-9]。
从诊断的角度而言,HLH-2004诊断标准在儿童中的诊断意义已经在医疗界得到一致认可。在成人HPS诊断时,研究者建议结合患者病情和临床情况共同做出诊断,相关参数取值时间范围为血常规±3 d,低纤维蛋白原±3 d,高甘油三酯±5 d[17]。研究显示在满足HLH-2004诊断标准3项标准时其诊断敏感度为100.0%、特异度为77.8%,满足4项标准时敏感度为95.0%、特异度为93.6%,满足至少5项标准时敏感度为72.5%、特异度为98.7%[17]。由于过早开启标准化治疗(地塞米松联合依托泊苷)可能会对患者诊断和预后产生不利的影响[9],近年来单纯激素治疗在一些研究中得到了认可,而针对激素治疗对于HPS诊断和预后影响的相关研究较少。因此,笔者回顾收集了本院急诊科诊断HPS患者激素应用情况及治疗5~7 d后相关指标的变化,以分析激素治疗对HPS诊断建立的影响。18例患者在满足4项HLH-2004诊断标准时应用了激素治疗,16例在满足至少5项HLH-2004诊断标准后开始激素治疗。研究发现满足4项HLH-2004诊断标准时开始激素治疗,治疗后临床指标可逐步满足诊断标准,激素治疗前后满足诊断标准项目数量(HLH-2004诊断标准)差异有统计学意义,15例治疗后满足至少5项HLH-2004诊断标准,全部18例患者均满足Hscore诊断标准(≥169分),其中甘油三酯达标率明显增加,考虑可能与其变化的时间窗相关。常规项目组和非常规项目组在满足HLH-2004项目数量和HScore评分上差异无统计学意义。因此,笔者认为在满足4项HLH-2004诊断标准的情况时,根据患者临床情况个体化选择早期应用激素治疗,对患者最终HPS诊断的建立无明显影响。
从治疗的角度而言,研究发现依据HLH-2004诊断标准可能会导致早期治疗延迟,需要早期治疗的患者可能并不能达到至少5项HLH-2004诊断标准,部分患者在仅满足3或4项HLH-2004诊断标准时,即满足Hscore > 169分标准,需要启动治疗[18]。研究指出排除恶性疾病(如白血病、淋巴瘤)后,在等待诊断建立时即可开始激素治疗[10]。因此,笔者回顾性分析了本院急诊科HPS患者在不同情况下应用激素治疗对疾病严重程度、治疗应答及临床预后的影响。本研究发现在满足4项HLH-2004诊断标准时应用激素治疗与满足至少5项标准时应用激素治疗相比:前者的住院时间较短,PT、APTT可以在治疗5~7 d后得到更好的纠正;治疗后APACHE Ⅱ评分、SOFA评分相对较低,但差异无统计学意义;1周后治疗应答和院内病死率、60 d生存率差异无统计学意义,其他指标(体温控制时间、丙氨酸转氨酶、高密度脂蛋白、ALB、TBil、肌酐、血钠)均差异无统计学意义。提前激素治疗常规项目组和非常规项目组对比显示,APACHE Ⅱ评分、SOFA评分、治疗应答、临床预后及激素治疗后相关临床指标均差异无统计学意义。因此,本研究认为在满足4项HLH-2004诊断标准的成人HPS患者,依据临床评估可以考虑早期应用激素治疗,治疗造成有害的免疫抑制的可能性较小,对院内病死率和60 d生存率无明显影响,但是可以有效的降低住院时间。
本研究还存在一些局限性,研究资料中没有区分导致HPS的不同病因,是单中心、回顾性研究,样本量较小。
综上所述,HPS治疗中,激素是急诊科常用的一线治疗药物,在满足4项HLH-2004诊断标准时,应用单独激素治疗对患者HPS的临床诊断建立无明显影响,对治疗应答、院内病死率和60 d生存率无明显影响,可以更快的纠正凝血功能,有效的减少住院时间。笔者认为随着对于HPS认识的增加,检查手段的完善与提高,急诊医生高度怀疑患者HPS诊断时,可以考虑更早的(满足4项HLH-2004诊断标准)开始激素治疗。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王武超:研究设计,数据收集及整理,统计学分析,文章撰写;刘思齐:数据收集及整理,统计学分析,论文修改;朱继红:研究设计,统计学分析,论文修改
| [1] | Lachmann G, la Rosée P, Schenk T, et al. Hemophagocytic lymphohistiocytosis: a diagnostic challenge on the ICU[J]. Anaesthesist, 2016, 65(10): 776-786. DOI:10.1007/s00101-016-0216-x |
| [2] | la Rosée P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults[J]. Blood, 2019, 133(23): 2465-2477. DOI:10.1182/blood.2018894618 |
| [3] | Ramos-Casals M, Brito-Zerón P, López-Guillermo A, et al. Adult haemophagocytic syndrome[J]. Lancet, 2014, 383(9927): 1503-1516. DOI:10.1016/S0140-6736(13)61048-X |
| [4] | Créput C, Galicier L, Buyse S, et al. Understanding organ dysfunction in hemophagocytic lymphohistiocytosis[J]. Intens Care Med, 2008, 34(7): 1177-1187. DOI:10.1007/s00134-008-1111-y |
| [5] | Ménasché G, Feldmann J, Fischer A, et al. Primary hemophagocytic syndromes point to a direct link between lymphocyte cytotoxicity and homeostasis[J]. Immunol Rev, 2005, 203: 165-179. DOI:10.1111/j.0105-2896.2005.00224.x |
| [6] | Machowicz R, Janka G, Wiktor-Jedrzejczak W. Similar but not the same: differential diagnosis of HPS and Sepsis[J]. Crit Rev Oncol Hematol, 2017, 114: 1-12. DOI:10.1016/j.critrevonc.2017.03.023 |
| [7] | Ehl S, Astigarraga I, von Bahr Greenwood T, et al. Recommendations for the use of etoposide-based therapy and bone marrow transplantation for the treatment of HPS: consensus statements by the HPS steering committee of the histiocyte society[J]. J Allergy Clin Immunol Pract, 2018, 6(5): 1508-1517. DOI:10.1016/j.jaip.2018.05.031 |
| [8] | Trottestam H, Horne A, Aricò M, et al. Chemoimmunotherapy for hemophagocytic lymphohistiocytosis: long-term results of the HPS-94 treatment protocol[J]. Blood, 2011, 118(17): 4577-4584. DOI:10.1182/blood-2011-06-356261 |
| [9] | Jordan MB, Allen CE, Greenberg J, et al. Challenges in the diagnosis of hemophagocytic lymphohistiocytosis: recommendations from the North American consortium for Histiocytosis (NACHO)[J]. Pediatr Blood Cancer, 2019, 66(11): e27929. DOI:10.1002/pbc.27929 |
| [10] | Marsh RA, Allen CE, Mcclain KL, et al. Salvage therapy of refractory hemophagocytic lymphohistiocytosis with alemtuzumab[J]. Pediatric Blood & Cancer, 2013, 60(1): 101-109. DOI:10.1002/pbc.24188.fd |
| [11] | Marsh RA, Haddad E. How i treat primary haemophagocytic lymphohistiocytosis[J]. Br J Haematol, 2018, 182(2): 185-199. DOI:10.1111/bjh.15274 |
| [12] | Ammann S, Lehmberg K, Zur Stadt U, et al. Effective immunological guidance of genetic analyses including exome sequencing in patients evaluated for hemophagocytic lymphohistiocytosis[J]. J Clin Immunol, 2017, 37(8): 770-780. DOI:10.1007/s10875-017-0443-1 |
| [13] | Lao K, Sharma N, Gajra A, et al. Hemophagocytic lymphohistiocytosis and bone marrow hemophagocytosis: a 5-year institutional experience at a tertiary care hospital[J]. South Med J, 2016, 109(10): 655-660. DOI:10.14423/SMJ.0000000000000546 |
| [14] | Hayden A, Park S, Giustini D, et al. Hemophagocytic syndromes (HPSs) including hemophagocytic lymphohistiocytosis (HPS) in adults: a systematic scoping review[J]. Blood Rev, 2016, 30(6): 411-420. DOI:10.1016/j.blre.2016.05.001 |
| [15] | Madkaikar M, Shabrish S, Desai M. Current updates on classification, diagnosis and treatment of hemophagocytic lymphohistiocytosis (HPS)[J]. Indian J Pediatr, 2016, 83(5): 434-443. DOI:10.1007/s12098-016-2037-y |
| [16] | Janka GE. Familial hemophagocytic lymphohistiocytosis[J]. Eur J Pediatr, 1983, 140(3): 221-230. DOI:10.1007/BF00443367 |
| [17] | Knaak C, Nyvlt P, Schuster FS, et al. Hemophagocytic lymphohistiocytosis in critically ill patients: diagnostic reliability of HLH-2004 criteria and HScore[J]. Crit Care, 2020, 24(1): 244. DOI:10.1186/s13054-020-02941-3 |
| [18] | Gualdoni GA, Hofmann GA, Wohlfarth P, et al. Prevalence and outcome of secondary hemophagocytic lymphohistiocytosis among SIRS patients: results from a prospective cohort study[J]. J Clin Med, 2019, 8(4): E541. DOI:10.3390/jcm8040541 |
 2022, Vol. 31
2022, Vol. 31




